题目内容
20.ClO2是一种广谱、高效的杀菌消毒剂,具有强氧化性,熔点为-59℃,沸点为11.0℃,不稳定,易溶于水.某研究小组在60℃时用硫铁矿还原氯酸钠制取并收集二氧化氯.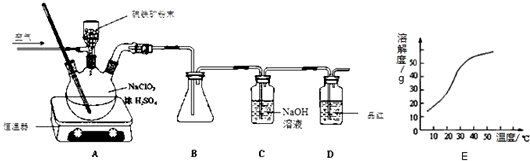
(1)三颈烧瓶中加入NaClO3溶液、浓H2SO4,通入空气,温度为60℃时,通过固体加料器缓慢匀速加入硫铁矿粉末.反应开始时烧瓶内发生反应的离子方程式如下,请配平:
15 ClO3-+1 FeS2+14 H+=15 ClO2+1 Fe3++2 SO42-+7 H2O
(2)凝集装置B必须添加温度控制装置,应该是冰水浴装置.
(3)装置D的作用是检验ClO2是否吸收完全.
(4)反应后在装置C中可得NaClO2溶液.已知NaClO2饱和溶液在温度低于38℃时析出晶体是NaClO2•3H2O,在温度高于38℃时析出晶体是NaClO2.请补充从NaClO2溶液中制得NaClO2晶体的操作步骤:
①蒸发结晶;②趁热过滤;③洗涤;④干燥.
(5)用水吸收ClO2可得到ClO2溶液.为测定所得溶液中ClO2的含量,进行了下列实验.:
步骤1:准确量取ClO2溶液10mL,稀释成100mL试样,量取V1 mL试样加入到锥形瓶中.
步骤2:调节试样的pH≤2.0,加入足量的KI晶体,静置片刻.
步骤3:加入淀粉指示剂,用c mol/L Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2mL.
(已知2Na2S2O3+I2=Na2S4O6+2NaI)
①写出步骤2中发生反应的离子方程式2ClO2+10I-+8H+=2Cl-+5I2+4H2O.
②原ClO2溶液的浓度为$\frac{135CV{\;}_{2}}{V{\;}_{1}}$g/L(用含字母的代数式表示).
分析 (1)NaClO3与FeS2的反应中,氯从+5价变为+4价,铁从+2价变为+3价,硫从-2价变为+6价,根据化合价升降法结合电荷守恒和元素守恒配平离子方程式;
(2)ClO2熔点为-59℃,沸点为11.0℃,B中要收集ClO2,要有冰水浴;
(3)ClO2有强氧化性,能使品红褪色,通过品红可以判断ClO2是否吸收完全;
(4)从溶液中制取溶质,一般采用蒸发结晶、过滤、洗涤、干燥的方法;
(5)①ClO2有强氧化性,在酸性条件下将碘离子氧化成碘单质,同时生成氯离子,根据电荷守恒和元素守恒书写离子方程式;
②根据关系式2ClO2~5I2~10Na2S2O3计算c(ClO2).
解答 解:(1)NaClO3与FeS2的反应中,氯从+5价变为+4价,铁从+2价变为+3价,硫从-2价变为+6价,根据化合价升降法结合电荷守恒和元素守恒配平离子方程式为15ClO3-+FeS2+14H+=15ClO2+Fe3++2SO42-+7H2O,
故答案为:15;1;14;15;1;2;7;
(2)ClO2熔点为-59℃,沸点为11.0℃,B中要收集ClO2,要用冰水浴装置,
故答案为:冰水浴;
(3)ClO2有强氧化性,能使品红褪色,所以装置D的作用是检验ClO2是否吸收完全,
故答案为:检验ClO2是否吸收完全;
(4)从溶液中制取溶质,一般采用蒸发结晶、过滤、洗涤、干燥的方法,防止析出晶体NaClO2•3H2O,趁热过滤,
故答案为:蒸发结晶;趁热过滤;
(5)①ClO2有强氧化性,在酸性条件下将碘离子氧化成碘单质,同时生成氯离子,反应的离子方程式为2ClO2+10I-+8H+=2Cl-+5I2+4H2O,
故答案为:2ClO2+10I-+8H+=2Cl-+5I2+4H2O;
②设原ClO2溶液的浓度为x,
2ClO2~5I2~10Na2S2O3
2mol 10mol
$\frac{10{\;}^{-2}x×V{\;}_{1}×10{\;}^{-3}}{1{0}^{-1}}$ 1×10-3cV2mol
x=$\frac{2cV{\;}_{2}}{{V}_{1}}$mol/L=$\frac{135CV{\;}_{2}}{V{\;}_{1}}$g/L,
故答案为:$\frac{135CV{\;}_{2}}{V{\;}_{1}}$.
点评 本题考查物质的制备、对信息的利用、对装置的理解、氧化还原反应等,理解反应原理,掌握实验基本操作是解题的关键,同时考查学生分析问题、解决问题的能力,难度较大,注意氧化还原反应的计算.

 名校课堂系列答案
名校课堂系列答案 (“→”表示反应一步完成)关系转化的是( )
(“→”表示反应一步完成)关系转化的是( )| 选项 | a | b | c |
| A | NO | NO2 | HNO3 |
| B | SiO2 | Na2SiO3 | H2SiO3 |
| C | Al | NaAlO2 | Al(OH)3 |
| D | MgCl2 | Mg(OH)2 | MgO |
| A. | A | B. | B | C. | C | D. | D |
| A. | 液溴保存过程中,应在其液面上加少量水进行液封 | |
| B. | 少量的碱金属单质均应保存在煤油中 | |
| C. | FeCl3溶液存放时应加少量盐酸 | |
| D. | AgNO3溶液和KMnO4溶液均应存放在棕色试剂瓶中 |
| A. | x=0.5,a=8 | B. | x=0.5,a=10 | C. | x=1.5,a=8 | D. | x=1.5,a=10 |

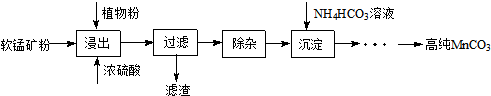
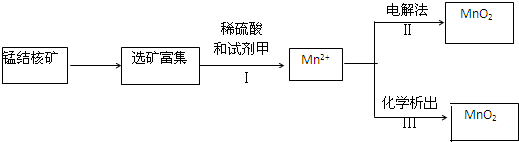
 营养品和药品都是保证人类健康不可缺少的物质,其性质和制法是化学研究的主要内容.已知酪氨酸是一种生命活动不可缺少的氨基酸,它的结构简式是:
营养品和药品都是保证人类健康不可缺少的物质,其性质和制法是化学研究的主要内容.已知酪氨酸是一种生命活动不可缺少的氨基酸,它的结构简式是: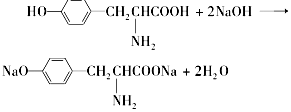 .
.