题目内容
盖斯定律在生产和科学研究中有很重要的意义,有些反应的反应热虽然无法直接测得,但可以用盖斯定律间接求得。已知3.6 g碳在6.4 g的氧气中燃烧,至反应物耗尽,并放出x kJ热量;已知每摩尔单质碳完全燃烧生成CO2放出热量为y kJ,则1 mol C与O2反应生成CO的反应热ΔH为
| A.-y kJ·mol-1 | B.-(10x-y)kJ·mol-1 |
| C.-(5x-0.5y)kJ·mol-1 | D.+(10x-y)kJ·mol-1 |
C
解析试题分析:3.6g碳的物质的量=3.6g÷12g/mol=0.3mol,6.4g氧气的物质的量=6.4g÷32g/mol=0.2mol。因此二者反应生成的是CO与CO2的混合气,其中CO是0.2mol,CO2是0.1mol。已知每摩尔单质碳完全燃烧生成CO2放出热量为y kJ,则生成0.1molCO2放出的热量是0.1ykJ。则生成0.2molCO放出的热量是xkJ-0.1ykJ,所以1 mol C与O2反应生成CO的反应热ΔH=-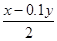 ×10kJ/mol=-(5x-0.5y)kJ·mol-1,答案选C。
×10kJ/mol=-(5x-0.5y)kJ·mol-1,答案选C。
考点:考查反应热的计算

 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案氯原子对O3的分解有催化作用:O3+Cl=ClO+O2 ΔH1 ClO+O=Cl+O2ΔH2
该反应的能量变化如图示意,下列叙述中正确的是
| A.反应O3+ O=2O2的ΔH=E1-E2 |
| B.反应O3+ O=2O2的ΔH=E2-E3 |
| C.反应O3+ O= 2O2是吸热反应 |
| D.反应O3+ O=2O2的ΔH=ΔH1+ΔH2 |
以下变化后物质的总能量升高的是
| A.钢铁生锈 | B.气态SO3变成固态三聚物 |
| C.水电解 | D.1,3-环己二烯生成苯 |
下列热化学方程式书写正确的是(ΔH的绝对值均正确) ( )
| A.C(s)+1/2O2(g)=CO(g) ΔH=-110.5kJ·mol-1 (燃烧热) |
| B.2H2O(g)=2H2(g)+O2(g) ΔH=+483.6 kJ·mol-1(反应热) |
| C.C2H5OH+3O2=2CO2+3H2O ΔH=-1368.8 kJ·mol-1(反应热) |
| D.2NaOH(aq)+H2SO4(aq)=Na2SO4 (aq)+2H2O(l) ΔH=-114.6 kJ·mol-1(中和热) |
已知在25℃时:2C(s)+O2(g)=2CO(g) △H1=-222kJ/mol
2H2(g)+O2(g)=2H2O(g) △H2=-484kJ/mol
C(s)+O2(g)=CO2(g) △H3=-394kJ/mol
则25℃时,CO(g)+H2O(g)=CO2(g)+H2(g)的反应热△H4为
| A.-82kJ/mol | B.-41kJ/mol | C.-312kJ/mol | D.+82kJ/mol |
下列依据热化学方程式得出的结论正确的是
| A.已知C(石墨, s)=C(金刚石, s) ΔH>0,则金刚石比石墨稳定 |
| B.已知C(s)+O2(g)=CO2(g) ΔH1;C(s)+1/2O2(g)=CO(g) ΔH2,则ΔH2>ΔH1 |
| C.已知2H2(g)+O2(g)=2H2O(g) ΔH=" -483.6" kJ/mol,则氢气的燃烧热为241.8kJ/mol |
| D.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH=-57.3kJ/mol,则含20gNaOH的稀溶液与稀盐酸完全中和,中和热为28.65kJ/mol |
某反应能量变化如右下图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能)。下列叙述正确的是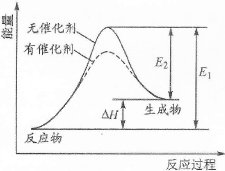
| A.该反应为放热反应 |
| B.催化剂能改变反应的焓变 |
| C.催化剂能降低反应的活化能 |
| D.逆反应的活化能大于正反应的活化能 |
下列说法正确的是
| A.需加热才能发生的反应一定是吸热反应 |
| B.任何放热反应在常温条件一定能发生反应 |
| C.反应物和生成物分别具有的总能量决定了反应是放热反应还是吸热反应 |
| D.当△H<0时表明反应为吸热反应 |
已知:NH3·H2O(aq)与H2SO4(aq)反应生成1 mol正盐的ΔH=
-24.2 kJ·mol-1;强酸、强碱的稀溶液反应的中和热ΔH=-57.3 kJ·mol-1。则NH3·H2O在水溶液中电离的ΔH等于( )
| A.-69.4 kJ·mol-1 | B.-45.2 kJ·mol-1 |
| C.+69.4 kJ·mol-1 | D.+45.2 kJ·mol-1 |