题目内容
氧族元素的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种化合价,含氧族元素的化合物在研究和生产中有许多重要用途。请回答下列问题:
(1) S单质的常见形式为S8,其环状结构如下图所示,S原子采用的轨道杂化方式是 。

(2)Se原子在元素周期表中位置为 ;
其基态原子核外价电子的轨道表示式为 。
(3)气态SeO3分子的立体构型为 。
(4)H+可与H2O形成H3O+,H3O+中存在的共价键类型为: 。H3O+中H—O—H键角比H2O中H—O—H键角大,原因为_____________________________________________________
(1)sp3(2分) (2)第四周期第ⅥA族;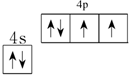 (各2分,共4分)
(各2分,共4分)
(3)(平面)三角形(2分) (4)极性(共价)键、配位健(各1分,共2分);
H2O中O原子有2对孤对电子,H2O+只有1对孤对电子,排斥力较小(2分)
【解析】
试题分析:(1)由S8分子结构可知,在S8分子中S原子成键电子对数为2,孤电子对数为2,即价层电子对数为4,因此S原子采用的杂化轨道方式为sp3。
(2)Se位于元素周期表第四周期第ⅥA族,原子序数为34,根据构造原理可知其核外电子排布式为1s22s22p63s23p63d104s24p4。所以根据能量最低原理、洪特规则和泡利不相容原理可知,基态原子核外价电子的轨道表示式为 。
。
(3)根据价层电子对互斥理论可知,SeO3分子中中心原子含有的孤对电子对数=(6-3×2)÷2=0,即气态SeO3分子中Se形成3个δ键,没有孤电子对,所以该分子形成的空间构型是平面三角形。
(4)H+可与H2O形成H3O+,H3O+中存在的共价键类型为极性(共价)键、配位健。由于H2O中O原子有2对孤对电子,H2O+只有1对孤对电子,排斥力较小,因此H3O+中H—O—H键角比H2O中H—O—H键角大。
考点:考查杂化轨道类型、核外电子排布、轨道表达式、分子空间构型以及化学键的判断等

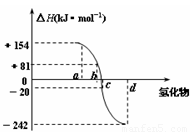
氧族元素包括氧、硫、硒、碲、钋等,右图为氧族元素氢化物a、b、c、d的生成热数据示意图,下列关于氧族元素的说明正确的
| A.含有18e-的两种氢化物中只存在极性键 |
| B.氢化物的沸点大小是H2O<H2S<H2Se<H2Te |
| C.a所对应的氢化物是H2O |
| D.每1mol H2S分解会吸收20KJ的热量 |
 氧族元素包括氧、硫、硒、碲、钋等,如图为氧族元素氢化物a、b、c、d的生成热数据示意图,下列关于氧族元素的说明正确的( )
氧族元素包括氧、硫、硒、碲、钋等,如图为氧族元素氢化物a、b、c、d的生成热数据示意图,下列关于氧族元素的说明正确的( )