题目内容
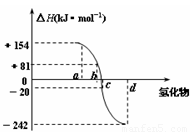
 氧族元素包括氧、硫、硒、碲、钋等,如图为氧族元素氢化物a、b、c、d的生成热数据示意图,下列关于氧族元素的说明正确的( )
氧族元素包括氧、硫、硒、碲、钋等,如图为氧族元素氢化物a、b、c、d的生成热数据示意图,下列关于氧族元素的说明正确的( )分析:A、依据18电子的化合物为过氧化氢和硫化氢,根据结构分析判断,
B、水分子间可以形成氢键,水的沸点反常的高;
C、根据元素周期律,同一主族元素非金属性越强,生成气态氢化物越容易,气态氢化物越稳定;非金属元素氢化物越稳定,△H越小,反之亦然;
D、依据图象分析和生成氢化物的热量变化分析,a为H2Te;b为H2Se;c为H2S;d为H2O;
B、水分子间可以形成氢键,水的沸点反常的高;
C、根据元素周期律,同一主族元素非金属性越强,生成气态氢化物越容易,气态氢化物越稳定;非金属元素氢化物越稳定,△H越小,反之亦然;
D、依据图象分析和生成氢化物的热量变化分析,a为H2Te;b为H2Se;c为H2S;d为H2O;
解答:解:A、依据18电子的化合物为过氧化氢和硫化氢,过氧化氢中含非极性键,故A错误;
B、水分子间可以形成氢键,水的沸点反常的高水的沸点高于其他氢化物,故B错误;
C、非金属元素氢化物的稳定性与生成1mol氢化物时的△H的关系为:根据元素周期律,同一主族元素非金属性越强,生成气态氢化物越容易,气态氢化物越稳定;而根据热力学,能量越低越稳定.非金属元素氢化物越稳定,△H越小;a、b、c、d依次为H2Te、H2Se、H2S、H2O.故C错误
D、依据图象分析a为H2Te;b为H2Se;c为H2S;d为H2O;每1mol H2S分解会吸收20KJ的热量,故D正确;
故选D.
B、水分子间可以形成氢键,水的沸点反常的高水的沸点高于其他氢化物,故B错误;
C、非金属元素氢化物的稳定性与生成1mol氢化物时的△H的关系为:根据元素周期律,同一主族元素非金属性越强,生成气态氢化物越容易,气态氢化物越稳定;而根据热力学,能量越低越稳定.非金属元素氢化物越稳定,△H越小;a、b、c、d依次为H2Te、H2Se、H2S、H2O.故C错误
D、依据图象分析a为H2Te;b为H2Se;c为H2S;d为H2O;每1mol H2S分解会吸收20KJ的热量,故D正确;
故选D.
点评:本题考查了氢化物的稳定性,沸点的比较依据和方法,同主族的递变规律和特殊性质是解题关键,题目难度中等.

练习册系列答案
相关题目
氧族元素包括氧、硫、硒、碲、钋等,右图为氧族元素氢化物a、b、c、d的生成热数据示意图,下列关于氧族元素的说明正确的
| A.含有18e-的两种氢化物中只存在极性键 |
| B.氢化物的沸点大小是H2O<H2S<H2Se<H2Te |
| C.a所对应的氢化物是H2O |
| D.每1mol H2S分解会吸收20KJ的热量 |