题目内容
【题目】下列物质的电子式书写正确的是①Ca(OH)2 ![]()
![]() ②H2S
②H2S ![]() ③OH-
③OH- ![]() ④Al3+ Al3+⑤N2
④Al3+ Al3+⑤N2 ![]() ⑥CO2
⑥CO2 ![]() ⑦HClO
⑦HClO ![]() ⑧Na2O2
⑧Na2O2 ![]()
A. ①②③④ B. ⑤⑥⑦⑧ C. ①④⑧ D. ②③⑤⑥⑦
【答案】C
【解析】
①Ca(OH)2为离子化合物; ②H2S为共价化合物,硫原子中最外层有8个电子达到稳定结构,分子中存在两个H-S键; ③OH-为带1个负电荷的阴离子;④Al3+,金属阳离子符号即为其电子式; ⑤N2 中N原子满足8个电子的稳定结构;⑥CO2中C分别为O形成2对共价键;⑦HClO,HClO分子中存在H-O和O-Cl两个共价键;⑧Na2O2是钠离子和过氧根离子构成的离子化合物。
①Ca(OH)2为离子化合物,电子式为:![]()
![]() ,故正确;②H2S为共价化合物,硫原子中最外层有8个电子达到稳定结构,分子中存在两个H-S键,电子式为:
,故正确;②H2S为共价化合物,硫原子中最外层有8个电子达到稳定结构,分子中存在两个H-S键,电子式为:![]() ,故错误;③氢氧根离子为带有1个单位负电荷的阴离子,需要标出离子中各原子最外层电子,氢氧根离子的电子式为:
,故错误;③氢氧根离子为带有1个单位负电荷的阴离子,需要标出离子中各原子最外层电子,氢氧根离子的电子式为:![]() ,故错误;④Al3+,金属阳离子符号即为其电子式,故正确;⑤N2中N原子满足8个电子的稳定结构,电子式为:
,故错误;④Al3+,金属阳离子符号即为其电子式,故正确;⑤N2中N原子满足8个电子的稳定结构,电子式为:![]() ,故错误;⑥CO2中C分别为O形成2对共价键;⑦HClO为共价化合物,分子中存在1个氧氢键和1个Cl-O键,次氯酸的电子式为:
,故错误;⑥CO2中C分别为O形成2对共价键;⑦HClO为共价化合物,分子中存在1个氧氢键和1个Cl-O键,次氯酸的电子式为:![]() ,故错误;⑧Na2O2是钠离子和过氧根离子构成的离子化合物,电子式为:
,故错误;⑧Na2O2是钠离子和过氧根离子构成的离子化合物,电子式为:![]() ,故正确,故正确的是:①④⑧,故选C。
,故正确,故正确的是:①④⑧,故选C。

 阅读快车系列答案
阅读快车系列答案【题目】已知:CH3CH2CH2CH2OH![]() CH3CH2CH2CHO。利用如图装置用正丁醇合成正丁醛。
CH3CH2CH2CHO。利用如图装置用正丁醇合成正丁醛。
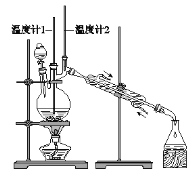
相关数据如下:
物质 | 沸点/℃ | 密度/(g·cm-3) | 水中溶解性 |
正丁醇 | 117.2 | 0.8109 | 微溶 |
正丁醛 | 75.7 | 0.8017 | 微溶 |
(1)实验过程中,所需正丁醇的量大于酸化的Na2Cr2O7的量,原因___________,加入药品时,应将_________________逐滴加入____________________中。
(2)为了实验的安全,还需在反应容器中加入____________________。
(3)反应过程中温度计1示数为_____℃,温度计2示数在_____时,收集产物。
(4)反应结束,为将正丁醛与水层分开,将馏出物倒入分液漏斗中,粗正丁醛从分液漏斗_____口分出。
(5)向获得的粗正丁醛中加入___________,检验其中是否含有少量水。

