题目内容
【题目】(5分)晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:
①高温下用碳还原二氧化硅制得粗硅
②粗硅与干燥HCl气体反应制得SiHCl3 :Si + 3HCl(g)![]() SiHCl3 + H2(g)
SiHCl3 + H2(g)
③SiHCl3与过量H2在1000-1100℃反应制得纯硅:
SiHCl3(g) + H2(g)![]() Si(s)+ 3HCl(g)
Si(s)+ 3HCl(g)
已知SiHCl3能与H2O剧烈反应,且在空气中易自燃。
用SiHCI3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去)
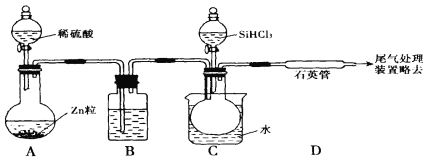
(1)装置B中的试剂是
(2)反应一段时间后,装置D中观察到的现象是 ,装置D不能采用普通玻璃管的原因是 。
(3)为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及 。
(4)为鉴定产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需再加入的试剂是 。(填写字母代号)
a.碘水 b.氯水 c. NaOH溶液 d. KSCN溶液 e. Na2SO3溶液
【答案】(1) 浓硫酸 (2)有固体物质生成;在该反应温度下,普通玻璃会软化
(3) 排尽装置中的空气 (4) bd
【解析】(1)由于SiHCl3能与H2O剧烈反应,所以生成的氢气需要干燥,选用浓硫酸作干燥剂。
(2)在高温下氢气将硅置换出来,生成单质硅,因此在装置D中有固体物质生成。因为反应的温度很高,在该反应温度下,普通玻璃会软化,所以装置D不能采用普通玻璃。
(3)由于在高温下硅和氧气可以化合生成二氧化硅,所以必须排尽装置中的空气。
(4)铁和盐酸反应生成的是亚铁离子,所以要具有铁的存在,在加入KSCN溶液之前,还需要加入氧化剂氯气,把亚铁离子氧化成铁离子,所以答案选bd。

 习题精选系列答案
习题精选系列答案【题目】Na2SO3溶液做为吸收液吸收SO2时,吸收液pH随n( ![]() ):n(
):n( ![]() )变化的关系如表:
)变化的关系如表:
n( | 91:9 | 1:1 | 9:91 |
Ph | 8.2 | 7.2 | 6.2 |
以下离子浓度关系的判断正确的是( )
A.NaHSO3溶液中c(H+)<c(OH﹣)
B.Na2SO3溶液中c(Na+)>c (SO ![]() )>c(HSO
)>c(HSO ![]() )>c(OH﹣)>c(H+)
)>c(OH﹣)>c(H+)
C.当吸收液呈中性时,c(Na+)>c(SO ![]() )>c(HSO
)>c(HSO ![]() )>c(OH﹣)=c(H+)
)>c(OH﹣)=c(H+)
D.当吸收液呈中性时,c(Na+)>c(HSO ![]() )+c(SO
)+c(SO ![]() )
)
【题目】无机化合物可根据其组成和性质进行分类:

(1)上图所示的物质分类方法名称是________。
(2)以H、O、N、S中两种或三种元素组成合适的物质,分别填在下表②③⑥处。
物质类别 | 酸 | 碱 | 盐 | 氧化物 |
化学式 | ①HCl ②____ | ③______ ④Ba(OH)2 | ⑤Na2CO3 ⑥______ | ⑦CO2 ⑧Na2O2 |
(3)过量⑦通入④中反应的离子方程式:______________________________。
(4)设阿伏加德罗常数的值为NA。15.9g ⑤溶于水配制成250mL溶液,CO32-的粒子数为__________,Na+的物质的量浓度为_______________。
(5)上述八种物质中有两种可发生离子反应:NH4++OH-![]() NH3·H2O,其对应的化学反应方程式为____________________________________________________。
NH3·H2O,其对应的化学反应方程式为____________________________________________________。