题目内容
(13分)X、Y、Z、W是原子序数依次增大的短周期元素,且互不同族;其中只有两种为金属;X原子的最外层电子数与次外层电子数相等;X与W、Y与Z这两对原子的最外层电子数之和均为9。单质Y和W都可与浓的NaOH溶液反应。请回答下列问题:
(1)Y、Z、W的原子半径由小到大的顺序是________________________。
(2)ZW2的电子式是____________,它在常温下呈液态,形成晶体时,属于______晶体。
(3)工业生产单质Y的原理是_____________________________(用化学方程式表示)。
(4)X与Y化学性质相似,则X与浓的NaOH溶液反应的化学方程式是__________________。
(5)0.1 mol的单质W与50 mL 1.5 mol/L的FeBr2溶液反应,则被氧化的Fe2+ 和Br-的物质的量之比是___________ 。
(1)Cl<S<Al (2) ;分子
(3)2Al2O3 4Al + 3O2↑ (4)Be + 2NaOH = Na2BeO2 + H2 ↑ (5)3:5
【解析】因X原子的最外层电子数与次外层电子数相等,所以短周期元素中符合此条件的元素只有铍(Be),又因X与W、Y与Z的最外层电子数之和均为9,所以W的最外电子数为9—2=7,又因X、Y化学性质相似,根据周期表中的“对角线”规则,推知Y为铝(Al),则Z的最外层电子数应为9—3=6,再根据X、Y、Z、W原子数依次增大的信息可推知Z为硫、W为氯,因此:(1)Y、Z、W的原子半径可根据同周期元素原子半径随序数增大而减小规律,推知Cl<S<Al。
(2)SCl2的电子式可根据价键理论写出,即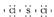 ,应属于分子晶体。
,应属于分子晶体。
(3)工业生产Al的方法是电解熔融的A12O3
(4)因X、Y的化学性质相似,根据A1与NaOH反应的知识,可推知X与NaOH溶液反应的方程式为Be+2NaOH=Na2BeO2+H2

(13分)X、Y、Z、W为常见含有相同电子数的离子或分子, 其中X微粒含有5个原子核,这些微粒与一氧化氮间有如下转化关系(图中部分反应物、产物及反应条件已略去)。
(1)Z →NO反应的化学方程式是:
液态 Z的电离与水的电离相似,电离生成电子数相同的两种微粒,写出液态Z的电离方程式 。
(2)实验室中检验Z的化学试剂及现象是:
|
|
化学试剂 |
现象 |
|
方法一 |
|
|
|
方法二 |
|
|
(3)由构成X、Y的三种元素所组成的一种离子化合物,且三种元素原子数之比为2︰4︰3,该离子化合物是 (填写化学式),其0.1 mol/L的该溶液显酸性,则该溶液中离子浓度由大到小的顺序为 。
(4)一定条件下,Z与一氧化氮或二氧化氮反应均可生成两种很稳定的产物。若有二氧化氮与Z的混合气体20 mL在该条件下反应,实际参加反应的二氧化氮比Z少2 mL,则原混合气两者的体积比是: