��Ŀ����
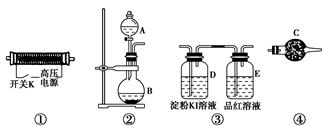
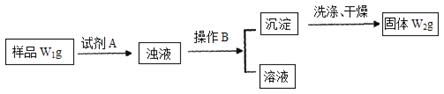
������CuSO4��5H2O����ͭ����Ҫ��������Ź㷺��Ӧ�á�������CuSO4��5H2O��ʵ�����Ʊ�����ͼ��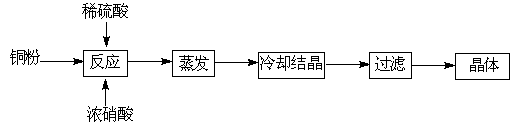
������и��⣺
��1����ͭ�۵�ϡ�����еμ�Ũ���ᣬ����ͭ�۵��ܽ���ܹ۲쵽��ʵ������ �� ��
��2���Ƶõĵ������壨CuSO4��5H2O���п��ܴ��ڵ������� ��д��ѧʽ����
��3�������������ⶨCuSO4��5H2O�ĺ���ʱ���������£�
��ȡ�������� �ڼ�ˮ�ܽ� �ۼ��Ȼ�����Һ���ɳ��� �ܹ��ˣ����ಽ��ʡ�ԣ�
�ڹ���ǰ����Ҫ�����Ƿ������ȫ��������� ��
��. ij�о���ѧϰС����ZRY-1�����ط����Ƕ�12.5������ͭ����(CuSO4��5H2O)�������ط��������¶ȵ����ߣ�����ͭ�������η������з�Ӧ��
a.CuSO4��5H2O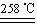 CuSO4��5H2O
CuSO4��5H2O
b.CuSO4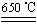 CuO��SO3����2SO3
CuO��SO3����2SO3 2SO2��O2
2SO2��O2
c.4CuO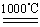 2Cu 2 O��O2��
2Cu 2 O��O2��
��ش��������⣺
��1��ʵ����������ط����Dz�ò�����������Ϊ3.8 g�����ƶϸù��������� (д��ѧʽ)�����Ӧ�����ʵ���֮���� ��
��2�����ط����Ǽ��Ⱦ��������غ�ȫ�����嵼����ͨ������������Һ��ַ�Ӧ�����ó��������ˡ�ϴ�ӡ��������Ϊ g��
��. ��1����Һ����ɫ���к���ɫ������� ��2��Cu(NO3)2
��3�����ϲ���Һ�м����μ��Ȼ�����Һ���۲�����������,���ޣ��������ȫ
��.��1��Cu2O��CuO��2�֣� 1��2��2�֣�(��ֵҪ��ǰһ�����ʴ����Ӧ,��n(Cu2O):n(CuO��="1:2" )
��2��11.65��2�֣�
���������������1����ͭ�۵�ϡ�����еμ�Ũ���ᣬ��Һ�д��������Ӻ���������ӣ���ʱͭ���൱�ں����ᷢ���˷�Ӧ���۲쵽��ʵ��������Һ����ɫ���к���ɫ�����������2�������Ʊ��д���������������Ƶõĵ������壨CuSO4��5H2O���п��ܴ��ڵ�������)Cu(NO3)2����3��Ҫ�����Ƿ������ȫ����ͨ����������������Ƿ��У�����������ϲ���Һ�м����μ��Ȼ�����Һ���۲�����������,���ޣ��������ȫ����.��1��12.5������ͭ����(CuSO4��5H2O)��0.05mol����ֻ��������ͭ����Ϊ0.05mol��4g���������ܡ���ֻ����������ͭ����Ϊ0.025mol(3.6g)�������ܣ����Բ���3.8 g����Ϊ������������ͭ��������ͭ���ʵ����ֱ�Ϊx��y������x+2y=0.05,80x+144y=3.8�����y:x=1:2����2����������Ͷ����������������ͭ�����ʵ�����ͬ����Ϊ0.05mol,��ȫ�����嵼����ͨ������������Һ��ַ�Ӧ�����ó��������ᱵ�������ᱵ�������ᱵ���ձ�����Ϊ���ᱵ����֪���ᱵ�����ʵ���Ϊ0.05mol,����Ϊ)11.65g��
���㣺���⿼�黯������ͼ�е����������

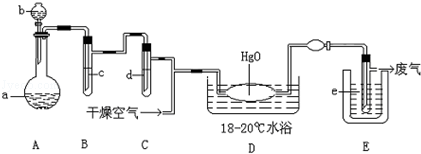
����������Ϣ��ҵ����Ҫ�Ļ������ϡ���ҵ�Ͽ��ý�̿���������Ļ�����ڸ�������������Ӧ����SiCl4��CO��SiCl4���ᴿ����������ԭ�øߴ��衣������ʵ�����Ʊ�SiCl4��װ��ʾ��ͼ��
ʵ������У�ʯӢɰ�е�������������Ҳ��ת��Ϊ��Ӧ�Ȼ��SiCl4��AlCl3��FeCl3��ˮ����ˮ�� ���й����ʵ������������±���
���й����ʵ������������±���
| ���� | SiCl4 | AlCl3 | FeCl3 |
| �е�/�� | 57.7 | �� | 315 |
| �۵�/�� | -70.0 | �� | �� |
| �����¶�/�� | �� | 180 | 300 |
��ش��������⣺
��1��д��װ��A�з�����Ӧ�����ӷ���ʽ��_____________�� װ��D��Ӳ�ʲ������з�����Ӧ�Ļ�ѧ����ʽ�� ��
 ��2��װ��C�е��Լ��� �� D��E�䵼�ܶ��Ҵֵ�ԭ���� ��
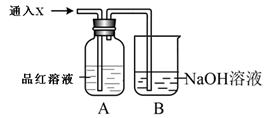
��2��װ��C�е��Լ��� �� D��E�䵼�ܶ��Ҵֵ�ԭ���� �� ��3��G������β��һ��ʱ�������Һ�п϶�����OH����Cl����SO42-�������ʵ�飬̽��������Һ�п��ܴ��ڵ�����������ӣ����Կ�����CO2��Ӱ�죩��
��3��G������β��һ��ʱ�������Һ�п϶�����OH����Cl����SO42-�������ʵ�飬̽��������Һ�п��ܴ��ڵ�����������ӣ����Կ�����CO2��Ӱ�죩����������衿����1��ֻ��SO32-������2������SO32-Ҳ��ClO��������3�� ��
����Ʒ���������ʵ�顿�ɹ�ѡ���ʵ���Լ��У�3 mol/L H2SO4��1 mol/L NaOH��0.01 mol/L KMnO4����ˮ������-KI��Ʒ�����Һ��
ȡ��������Һ���Թ��У��μ�3 mol/L H2SO4����Һ�����ԣ�Ȼ��������Һ������a��b��c��֧�Թ��У��ֱ��������ʵ�顣������±���
| ��� | �� �� | ���ܳ��ֵ����� | ���� |
| �� | ��a�Թ��еμӼ��� ��Һ | ����Һ��ɫ | �����1���� |
| ����Һ����ɫ | �����2��3���� | ||
| �� | ��b�Թ��еμӼ��� ��Һ | ����Һ��ɫ | �����1��3���� |
| ����Һ����ɫ | ����2���� | ||
| �� | ��c�Թ��еμӼ��� ��Һ | | ����3���� |
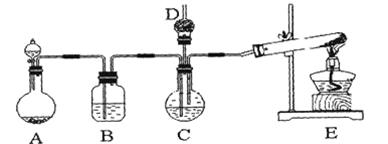
������ͭ�Ǵ���ˮ�潢������Ϳ�����Ҫԭ�ϡ�ijС����������о�������д���пհס�
ʵ��1��������ͭ����ȡ������ͭ���������Ǻ�����������ͭ����Һ��Ӧ��ȡ�����ױ������������Ʋ���ʱ��������CuO���ɡ�
��1��ʵ������ȡ������ͭ����Һ�����ӷ���ʽΪ____________��
��2��ʵ�����ô˷�����ȡ���������������ͭ���壬��Ҫ�IJ����������Թܡ��ƾ��ơ��ձ�____________��____________��
��3����Ҫ̽���÷�Ӧ����������¶ȣ�Ӧѡ�õļ��ȷ�ʽΪ____________��
ʵ��2���ⶨ������ͭ�Ĵ���
����1����ȡʵ��1���ù���m g����������װ�ý���ʵ�顣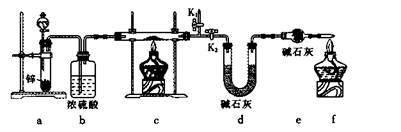
��4��װ��a�����ӵ�����____________���ѧʽ����
��5��ͨ������������������ܴﵽʵ��Ŀ�ĵ���____________��
| A����Ӧǰ��װ��a������ |
| B��װ��c��ַ�Ӧ�����ù�������� |
| C����Ӧǰ��װ��d������ |
| D����Ӧǰ��װ��e������ |
����2����ʵ��l���ù���mg��������ϡ���ᣬ�����ˡ�ϴ�ӡ������Ƴ�����������������ϣ�Cu2O+2H+=Cu2++Cu+H2O��
��7���жϾ������������IJ������Ƿ�����ȫ����IJ���������__________________________________��
��8����ʵ�����ò�����Ϊng�������Ʒ��������ͭ����������Ϊ________________��
��ҵ������������Ҫ�ɷ�ΪAl2O3����SiO2��Fe2O3�����ʣ�Ϊԭ��ұ�����Ĺ����������£������������е��ж���ȷ���ǣ�
| A���Լ�XΪϡ���ᣬ�����к��й�Ļ����� |
| B����ӦII������Al��OH��3�ķ�ӦΪ��CO2+AlO2-+2H2O�TAl��OH��3��+HCO3- |
| C��������ӣ�H+��������������ǿ��˳����OH-��CO32-��AlO2- |
| D��Al2O3�۵�ܸߣ���ҵ�ϻ��ɲ��õ������AlCl3ұ��Al |

 N2O3(g)����ƽ�ⳣ������ʽΪK = ��
N2O3(g)����ƽ�ⳣ������ʽΪK = ��