题目内容
短周期元素A、B、C、D在周期表中所处的位置如图所示。A、B、C、D四种元素的质子数之和为36。E元素原子的半径在同周期中最大,且E的离子与C的离子具有相同的电子层结构。则下列说法正确的是( )

A.元素A形成的气态氢化物一定是正四面体形分子
B.五种元素形成的氢化物中,C的氢化物的沸点最高
C.A、C两种元素可形成A3C2型化合物,该化合物在空气中不能燃烧
D.B、C、D、E四种元素的离子半径由大到小的顺序为D>B>C>E

A.元素A形成的气态氢化物一定是正四面体形分子
B.五种元素形成的氢化物中,C的氢化物的沸点最高
C.A、C两种元素可形成A3C2型化合物,该化合物在空气中不能燃烧
D.B、C、D、E四种元素的离子半径由大到小的顺序为D>B>C>E
D
设B的原子序数为z,则A、C、D的原子序数分别为z-1、z+1、z+8,故有z-1+z+z+1+z+8=36,z=7,因此A、B、C、D分别为碳、氮、氧、磷。E元素原子的半径在同周期中最大,则E为第ⅠA族元素,E的离子与C的离子具有相同的电子层结构,故E为Na。C形成的气态氢化物较多,不一定为正四面体形分子,如乙烯为平面结构,A错误;NaH为离子化合物,沸点最高,B错误;C3O2中C的价态低于+4价,可以被氧气氧化,C错误;B、C、E的离子具有相同的电子层结构,核电荷数越大,离子半径越小,故离子半径B>C>E,B、D同主族,D的离子半径大于B的离子半径,D正确。

练习册系列答案
相关题目
 和
和 两种新原子。下列有关
两种新原子。下列有关 NF3+ 3NH4F
NF3+ 3NH4F TaS2(s)+2I2(g)+Q kJ,Q>0
TaS2(s)+2I2(g)+Q kJ,Q>0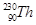 和
和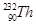 是钍的两种同位素,
是钍的两种同位素,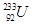 。下列有关Th的说法正确的是( )
。下列有关Th的说法正确的是( )