题目内容
(4分)将4 mol SO3气和4 molNO置于2L容器中,一定条件下发生如下可逆反应(不考虑NO2和N2O4之间的相互转化):?2SO3(g)  2SO2+O2?2NO+O2
2SO2+O2?2NO+O2 2NO2?
2NO2?
(1)当上述系统达到平衡时,O2和NO2的物质的量分别为n(O2)="0.1" mol、n(NO2)="3.6" mol,则此时SO3气的物质的量为 。?
(2)当上述系统达到平衡时,欲求其混合气体的平衡组成,则至少还需要知道两种气体的平衡浓度,但这两种气体不能同时是SO3和 ,或NO和 (填它们的分子式)。
 2SO2+O2?2NO+O2
2SO2+O2?2NO+O2 2NO2?
2NO2?(1)当上述系统达到平衡时,O2和NO2的物质的量分别为n(O2)="0.1" mol、n(NO2)="3.6" mol,则此时SO3气的物质的量为 。?
(2)当上述系统达到平衡时,欲求其混合气体的平衡组成,则至少还需要知道两种气体的平衡浓度,但这两种气体不能同时是SO3和 ,或NO和 (填它们的分子式)。
(4分)(1)0.2mol (2分) (2)SO2 NO2 (2分)
略

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
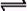 cC(g)+dD(g),C物质的体积分数(C%)与温度、压强的关系如图所示.
cC(g)+dD(g),C物质的体积分数(C%)与温度、压强的关系如图所示.
 ?xC(g)+2D(g)。2 min末该反应达到平衡,生成0.8 mol D,并测得C的浓度为0.2 mol·L-1。下列判断错误的是( )
?xC(g)+2D(g)。2 min末该反应达到平衡,生成0.8 mol D,并测得C的浓度为0.2 mol·L-1。下列判断错误的是( ) Na2S(s)+4H2O(g)。下列说法正确的是
Na2S(s)+4H2O(g)。下列说法正确的是 2NO2(g),当测得N2O4转化率为33.3%时,混合气体平均式量是 ( )
2NO2(g),当测得N2O4转化率为33.3%时,混合气体平均式量是 ( ) 2 NH3(g),平衡时混合气体共7 mol.令a、b、c分别代表N2、H2、NH3起始加入的物质的量,维持温度不变,使达到平衡时各成分的百分含量不变.则:
2 NH3(g),平衡时混合气体共7 mol.令a、b、c分别代表N2、H2、NH3起始加入的物质的量,维持温度不变,使达到平衡时各成分的百分含量不变.则: 、Y、Z表示元素符号)。讨论上述实验过程中离子浓度的大小顺序、对应溶质的化学式和溶液的pH。试填写表中空白(要求填写有关粒子化学式):
、Y、Z表示元素符号)。讨论上述实验过程中离子浓度的大小顺序、对应溶质的化学式和溶液的pH。试填写表中空白(要求填写有关粒子化学式): Z(g)+2W(g) △H<0。达到平衡(Ⅰ)时,B中密度变为原来的
Z(g)+2W(g) △H<0。达到平衡(Ⅰ)时,B中密度变为原来的 ,试回答:
,试回答: