题目内容
下列化学用语的相关表述正确的有 ( )
| A.H+(aq)+OH-(aq)=H2O(l) ΔH=" -a" kJ/mol,故1 mol NaOH固体与足量的稀盐酸反应,放出热量为a kJ |
| B.因CuSO4·5H2O(s)=CuSO4(s)+5H2O(l) ΔH="+b" kJ/mol,故1 mol CuSO4(s)溶于水时,放出热量b kJ |
| C.因氢气的燃烧热为c kJ/mol,故电解水的热化学方程式为:2H2O(l)=2H2(g)+O2(g) ΔH="+c" kJ/mol |
D.因N2(g)+3H2(g)  2NH3(g) ΔH=" -" d kJ/mol,故在某容器中投入1 mol N2与3 mol H2充分反应后,放出热量小于d kJ 2NH3(g) ΔH=" -" d kJ/mol,故在某容器中投入1 mol N2与3 mol H2充分反应后,放出热量小于d kJ |
D
解析试题分析:A H+(aq)+OH-(aq)=H2O(l) ΔH=" -a" kJ/mol,表示酸碱中和反应的反应热为a kJ。但由于NaOH溶解于水时放热,所以1 mol NaOH固体与足量的稀盐酸反应,放出热量大于a kJ。错误。B.因CuSO4·5H2O(s)=CuSO4(s)+5H2O(l) ΔH="+b" kJ/mol,故1 mol CuSO4(s)溶于水时,吸收热量b kJ。错误。C.氢气的燃烧热为c kJ/mol,故电解水的热化学方程式为:2H2O(l)=2H2(g)+O2(g) ΔH="+2c" kJ/mol.错误。D.反应N2(g)+3H2(g)  2NH3(g) ΔH=" -" d kJ/mol,表示每摩尔的该反应发生,放出热量为d kJ。由于该反应是可逆反应,故在某容器中投入1 mol N2与3 mol H2不可能完全反应,所以放出热量小于d kJ。正确。
2NH3(g) ΔH=" -" d kJ/mol,表示每摩尔的该反应发生,放出热量为d kJ。由于该反应是可逆反应,故在某容器中投入1 mol N2与3 mol H2不可能完全反应,所以放出热量小于d kJ。正确。
考点:考查燃烧热、中和热、溶解热与可能反应的热量转化关系的知识。

 天天向上口算本系列答案
天天向上口算本系列答案根据下列热化学方程式
(1)C(s)+O2(g)=CO2(g) △H1=-393.5 kJ/mol
(2)H2(g)+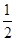 O2(g)=H2O(1) △H2=-285.8 kJ/mol
O2(g)=H2O(1) △H2=-285.8 kJ/mol
(3)CH3COOH(1)+2O2(g)=2CO2(g)+2H2O(1) △H3=-870.3 kJ/mol
可以计算出2C(s)+2H2(g)+O2(g)=CH3COOH(1)的△H为
| A.△H=+244.1kJ/mol | B.△H=-488.3 kJ/mol |
| C.△H=-996.6 kJ/mol | D.△H=+996.6 kJ/mol |
镁粉与碘粉均匀混合,滴加几滴水,发生剧烈反应,并产生大量紫色蒸气。以下叙述错误的是
| A.H2O作催化剂 | B.紫色蒸气是I2 |
| C.该反应是放热反应 | D.反应后物质的总能量升高 |
强酸与强碱的稀溶液发生中和反应的热效应:
H+(aq)+ OH-(aq) → H2O (l) +57.3kJ
向1L0.5mol/L的NaOH溶液中加入稀醋酸、浓硫酸、稀硝酸,则恰好完全反应时的热效应Q1、Q2、Q3的关系正确的是
| A.Q1 < Q2 < Q3 | B.Q1 > Q3 > Q2 | C.Q2 > Q1 > Q3 | D.Q1 < Q3 < Q2 |
生物质(通过光合作用产生的有机体)是一种可再生能源,能发生如下图转化。下列说法不正确的是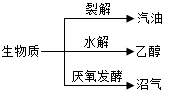
| A.汽油属于纯净物 |
| B.乙醇属于可再生能源 |
| C.沼气的主要成分是甲烷 |
| D.生物质能来源于太阳能 |
下列既是氧化还原反应,又是吸热反应的是( )
| A.葡萄糖在人体内氧化 |
| B.锌粒与稀H2SO4反应制取H2 |
| C.Ba(OH) 2·8H2O与NH4Cl反应 |
| D.二氧化碳与赤热的炭反应生成一氧化碳 |
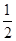 O2(g) ===CO(g);ΔH1 C(s)+O2(g) ===CO2(g);ΔH2
O2(g) ===CO(g);ΔH1 C(s)+O2(g) ===CO2(g);ΔH2