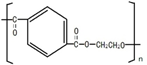
题目内容
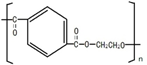
(1)PET的名称是______.
(2)PET在酸溶液中水解生成两种烃的含氧衍生物PTA
和EG(PTA分子量大于EG),PTA的结构简式是______;PTA有多种同分异构体,含三个官能团且官能团均处间位的芳香族同分异构体共有______种,其中一种的结构简式是______.
(3)PET的水解产物EG是重要的有机化工原料.EG和有机物甲、乙、丙间存在如下的转化关系(无机反应物、生成物均已略去):

甲乙丙分子内均只含一种官能团.乙+EG→丙反应类型是______;甲乙丙中的一种可以发生银镜反应,写出它与足量银氨溶液反应的化学方程式:______.
(2)通过以上分析知,PTA是对苯二甲酸,结构简式为
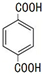
,PTA有多种同分异构体,含三个官能团且官能团均处间位的芳香族同分异构体共有2种,其中一种的结构简式是

,故答案为:

;2;

;
(3)一定条件下,乙二醇和乙二酸反应生成乙二酸乙二酯属于酯化反应或取代反应,乙二醛能和银氨溶液反应生成乙二酸铵和银、氨气和水,反应方程式为:

,
故答案为:酯化反应(或取代反应);

.

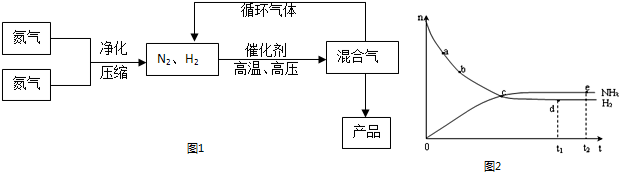
(15分)氨是最重要的氮肥,是产量最大的化工产品之一。课本里介绍的合成氨技术叫哈伯法,是德国人哈伯在1905年发明的,其合成原理为:N2(g)+3H2(g)  2NH3(g);△H<0他因此获得了1918年诺贝尔化学奖。工业上合成氨的部分工艺流程如下:
2NH3(g);△H<0他因此获得了1918年诺贝尔化学奖。工业上合成氨的部分工艺流程如下:

|
气体 |
氮气 |
氢气 |
氨 |
|
熔点(℃) |
-210.01 |
-252.77 |
-77.74 |
|
沸点(℃) |
-195.79 |
-259.23 |
-33.42 |
反应体系中各组分的部分性质见上表:
(1)合成氨反应的平衡常数很小,所以在工业上采取气体循环的流程。即反应后通过把混合气体的温度降低到 ℃使混合气体分离出来产品;继续循环的气体是 。
(2)工业上采取用上述(1)操作的目的:
。
(3)已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为________________________ 。
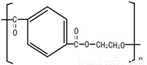
(4)合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应: N2(g)+3H2(g) 2NH3(g),在673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是
2NH3(g),在673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是

A.点a的正反应速率比点b的大
B.点 c处反应达到平衡
C.点d (t1时刻) 和点 e (t2时刻) 处n(N2)不一样
D.其他条件不变,773K下反应至t1时刻, n(H2)比上图中d点的值大