题目内容
【题目】下列说法错误的是
A. 抗酸药能中和胃里过多的盐酸,缓解胃部不适 ,是一类治疗胃痛的药
B. 碳酸镁、碳酸钡都能制成抗酸药
C. 青霉素有阻止多种细菌生长的优异功能,虽经1×107倍稀释,仍有疗效
D. 青霉素是重要的消炎药
【答案】B
【解析】试题分析:A、胃酸的主要成分为盐酸,抗酸药能中和胃里过多的盐酸,缓解胃部不适,故A正确;B、碳酸钡溶于盐酸,钡离子能使蛋白质变性,引起人体中毒,故B错误;C、青霉素属于抗生素,能破坏细菌的细胞壁并在细菌细胞的繁殖期起杀菌作用,故C正确;D、青霉素是重要的抗生素和消炎药,故D正确;故选B。

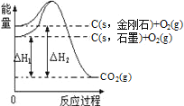
【题目】氢、氧两种元素组成的常见物质有H2O和H2O2,二者在一定条件下均可分解。
(1)已知:
化学键 | 断开1mol化学键所需的能量(kJ) |
H-H | 436 |
O-H | 463 |
O=O | 498 |
①H2O的电子式是________________。
②H2O(g)分解的热化学方程式是________________________。
③11.2 L(标准状况)的H2完全燃烧,生成气态水,放出__________kJ的热量。
(2)某同学以H2O2分解为例,探究浓度与溶液酸碱性对反应速率的影响。常温下,按照如表所示的方案完成实验。
实验编号 | 反应物 | 催化剂 | |
a | 50 mL5%H2O2溶液 | 1 mL0.1 mol·L-1FeCl3溶液 | |
b | 50 mL5%H2O2溶液 | 少量浓盐酸 | 1 mL0.1 mol·L-1FeCl3溶液 |
c | 50 mL5%H2O2溶液 | 少量浓NaOH溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
d | 50 mL5%H2O2溶液 | MnO2 | |
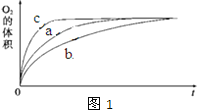
① 测得实验a、b、c中生成氧气的体积随时间变化的关系如图1所示。由该图能够得出的实验结论是______________________。
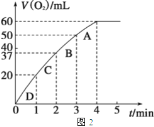
② 测得实验d在标准状况下放出氧气的体积随时间变化的关系如图2所示。解释反应速率变化的原因________________;计算H2O2的初始物质的量浓度为________________ (保留两位有效数字)。