题目内容
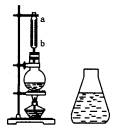
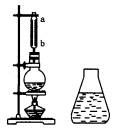
如图是制备乙酸乙酯的装置图,在左试管中先加入2 mL 95%的乙醇,并在摇动下缓缓加入3 mL浓硫酸,再加入2 mL乙酸,充分摇匀.在右试管中加入5 mL饱和Na2 CO3溶液.按图连接好装置,用酒精灯对左试管小火加热3~5 min后,改用大火加热,当观察到右试管中有明显现象时停止实验.
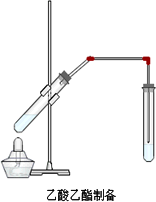
(1)写出左试管中主要反应的化学方程式:________;
(2)加入浓硫酸的作用:________、________;
(3)饱和Na2CO3溶液的作用是:________;
(4)反应开始时用酒精灯对左试管小火加热的原因是:________;(已知乙酸乙酯的沸点为77℃;乙醇的沸点为78.5℃;乙酸的沸点为117.9℃)
(5)分离右试管中所得乙酸乙酯和Na2CO3溶液的操作为(只填名称)________,所需主要仪器为________.
(6)实验生成的乙酸乙酯,其密度比水________,有________气味.
答案:
解析:
解析:
|
(1) (2)催化剂 吸水剂(2分 每个1分) (3)吸收乙酸和乙醇、便于乙酸乙酯的析出.(2分 每个1分) (4)加快反应速率,同时又防止了反应物未来得及反应而挥发损失;(2分) (5)分液;分液漏斗.(2分) (6)小;果香.(2分) |

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
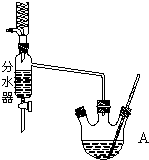 如图为制取乙酸乙酯的实验装置图.回答下列问题:
如图为制取乙酸乙酯的实验装置图.回答下列问题: