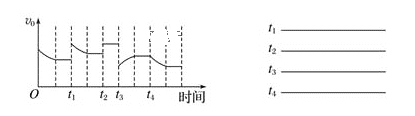
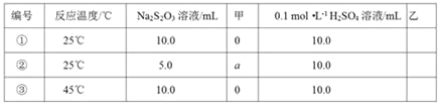
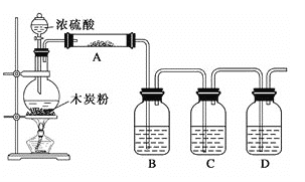
题目内容
【题目】25℃时纯水的电离度为a1,pH=2的醋酸溶液中水的电离度为a2,pH=12的氢氧化钠溶液中水的电离度为a3。若将上述醋酸与氢氧化钠溶液等体积混合,所得溶液中水的电离度为a4。下列关系式中正确的是( )
A. a2=a3<a4<a1B. a3=a2<a1<a4
C. a2<a3<a1<a4D. a1<a2<a3<a4
【答案】A
【解析】
在25℃时,纯水中c(H+)=c(OH-)=![]() =10-7mol·L-1,纯水的电离度为a1;pH=2的醋酸溶液中c(H+)=10-2mol·L-1,水电离出来的氢离子的浓度与氢氧根的浓度相等,即c(H+)水=c(OH-)水=
=10-7mol·L-1,纯水的电离度为a1;pH=2的醋酸溶液中c(H+)=10-2mol·L-1,水电离出来的氢离子的浓度与氢氧根的浓度相等,即c(H+)水=c(OH-)水=![]() mol·L-1=10-12mol·L-1,水的电离度为a2,醋酸电离出来的氢离子要抑制水的电离,a2<a1;同理可得pH=12的氢氧化钠溶液中c(OH-)=10-2mol·L-1,c(H+)水=c(OH-)水=
mol·L-1=10-12mol·L-1,水的电离度为a2,醋酸电离出来的氢离子要抑制水的电离,a2<a1;同理可得pH=12的氢氧化钠溶液中c(OH-)=10-2mol·L-1,c(H+)水=c(OH-)水=![]() mol·L-1=10-12mol·L-1,水的电离度为a3=a2<a1;pH=2的醋酸溶液和pH=12的氢氧化钠溶液等体积混合,醋酸是弱电解质,所以醋酸过量,溶液仍显酸性,溶液的pH<2,对水的电离抑制作用小于pH=2的醋酸溶液,c(H+)水=c(OH-)水>10-12mol·L-1,溶液中水的电离度为a4,所以有a2=a3<a4<a1;故选A。
mol·L-1=10-12mol·L-1,水的电离度为a3=a2<a1;pH=2的醋酸溶液和pH=12的氢氧化钠溶液等体积混合,醋酸是弱电解质,所以醋酸过量,溶液仍显酸性,溶液的pH<2,对水的电离抑制作用小于pH=2的醋酸溶液,c(H+)水=c(OH-)水>10-12mol·L-1,溶液中水的电离度为a4,所以有a2=a3<a4<a1;故选A。

 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案【题目】在花瓶中加入“鲜花保鲜剂”,能延长鲜花的寿命。下表是500mL“鲜花保鲜剂”中含有的成分,阅读后回答下列问题:
成分 | 质量(g) | 摩尔质量(g/mol) |
蔗糖 | 50.00 | 342 |
硫酸钾 | 0.87 | 174 |
阿司匹林 | 0.35 | 180 |
高锰酸钾 | 0.158 | 158 |
硝酸银 | 0.04 | 170 |
(1)下列“鲜花保鲜剂”的成分中,属于非电解质的是__________。
A.蔗糖 B.硫酸钾 C.高锰酸钾 D.硝酸
(2)在溶液配制过程中,下列操作正确且对配制结果没有影响的是__________。
A.将药品放入容量瓶中加蒸馏水溶解
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.容量瓶在使用前刚刚配制完一定物质的量浓度的NaCl溶液而未洗净
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理
(3)配制上述500mL“鲜花保鲜剂”所需的玻璃仪器有:烧杯、玻璃棒、_____________、__________。(在横线上填写所缺仪器的名称)
(4)鲜花保鲜剂中K+(蔗糖、阿司匹林中不含K+) 的物质的量浓度为______mol/L。