题目内容
海水中有丰富的资源,多种多样的海洋动物和植物,海底有丰富的矿藏、石油、天然气等,此外,海水中还含有大量的电解质,它们电离产生Cl-、Br-(溴离子)、SO42-、Na+、Mg2+、Ca2+等,都是重要资源。
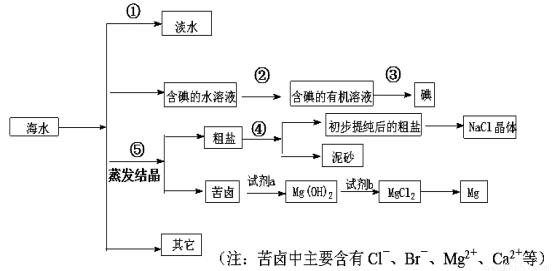
(1)写出步骤①、②、④分离提纯的方法:
① ; ② ; ④ 。
(2)步骤②分离提纯过程中需要选用主要玻璃仪器的名称 。
(3)欲除去初步提纯后的粗盐中的MgCl2、CaCl2和Na2SO4,应向该粗食盐水中依次加入NaOH溶液、 溶液、 溶液,然后过滤;为尽可能除去杂质,每次加入的试剂应 。向所得溶液中滴加 至无气泡产生,再经蒸发结晶得到食盐晶体。
(4)检验淡水中是否含有Cl-的操作现象及结论 。
(5)写出加入试剂a后,发生反应的离子方程式 。
(6)工业上用电解饱和食盐水的方法生产氯气、氢气和烧碱,请写出利用氯气和石灰乳制取漂白粉的化学方程式 ________________________________________________ 。
(1)①蒸馏 ②萃取分液 ④过滤 (2)②分液漏斗、烧杯
(3)BaCl2 Na2CO3 稍过量 稀盐酸(每空1分)
(4)取样,先滴加几滴稀硝酸,再滴加硝酸银,若产生白色沉淀则有Cl—(3分)。
(5)Mg2++2OH- =Mg(OH)2↓(2分) (6)2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O(2分)
【解析】
试题分析:(1)海水变为淡水最常用的的方法是蒸馏;单质碘易溶在有机溶剂中,因此要从含碘的溶液中中分离出单质碘应该用萃取然后分液即可;粗盐中含有难溶性物质,因此操作④是过滤。
(2)萃取分液的主要玻璃仪器是分液漏斗和烧杯。
(3)Ca2+用碳酸钠除去,Mg2+用氢氧化钠除去,SO42-用氯化钡除去,最后加入盐酸酸化。但由于过量的氯化钡要用碳酸钠来除,所以碳酸钠必需放在氯化钡的后面,而氢氧化钠可以随意调整。欲除去初步提纯后的粗盐中的MgCl2、CaCl2和Na2SO4,应向该粗食盐水中依次加入NaOH溶液、BaCl2溶液、Na2CO3溶液,然后过滤;为尽可能除去杂质,每次加入的试剂应稍过量。向所得溶液中滴加稀盐酸至无气泡产生,再经蒸发结晶得到食盐晶体。
(4)氯离子的检验一般用硝酸酸化的硝酸银溶液,因此检验淡水中是否含有Cl-的操作现象及结论是取样,先滴加几滴稀硝酸,再滴加硝酸银,若产生白色沉淀则有Cl—。
(5)加入试剂a后生成氢氧化镁白色沉淀,因此该试剂a是强碱,反应的离子方程式为Mg2++2OH- =Mg(OH)2↓。
(6)工业制取漂白粉的化学方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O。
考点:考查海水的综合应用、物质的分离与提纯、离子检验以及方程式的书写等
