题目内容
Ⅰ.现有以下物质:
①NaCl晶体 ②O2 ③液态HCl ④汞 ⑤BaSO4固体 ⑥纯蔗糖(C12H22O11) ⑦酒精(C2H5OH) ⑧熔化的KNO3
请回答下列问题(用序号):
(1)以上物质中能导电的是______.
(2)以上物质中属于电解质的是______.
Ⅱ.(1)写出下列反应的离子方程式:
①氧化铜和盐酸溶液:______.
②氢氧化钡溶液和稀硫酸溶液:______.
(2)写出氢气还原三氧化二铁的反应,并用双线桥分析该反应______;该反应的氧化剂是______,还原剂是______.
(3)已知铜在常温下能被稀硝酸溶解,其反应的化学方程式如下,用单线桥法分析该反应.
3Cu+8HNO3══3Cu(NO3)2+2NO↑+4H2O
从上述反应可得出物质的氧化性强弱顺序为______.
Ⅲ.①3.01×1023个HCl分子的物质的量是______.
②标准状况下,6.72L CH4的质量是______.
③将30mL 0.5mol/LNaOH溶液加水稀释到500mL,稀释后溶液中NaOH的物质的量浓度是______.
解:Ⅰ、①NaCl晶体是电解质,不能导电;②O2是单质不导电;③液态HCl是电解质不导电;④汞是单质导电;⑤BaSO4固体是电解质不导电;⑥纯蔗糖(C12H22O11)为非电解质不导电;⑦酒精(C2H5OH)为非电解质不导电;⑧熔化的KNO3为电解质能导电;
(1)以上物质中能导电的是④⑧,故答案为:④⑧;
(2)以上物质中属于电解质的是①③④⑧,故答案为:①③④⑧;
Ⅱ(1)①氧化铜是难溶于水的氧化物,离子方程式为:CuO+2H+=Cu2++H2O,故答案为:CuO+2H+=Cu2++H2O;
②氢氧化钡和硫酸反应生成沉淀硫酸钡和水,反应的离子方程式为:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,故答案为:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O;
(2)氢气还原三氧化二铁的反应为:Fe2O3+3H2=2Fe+3H2O;双线桥法表示为: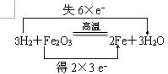 ,反应中铁元素化合价降低,则做Fe2O3氧化剂,反应中氢元素化合价升高,则H2为还原剂,故答案为:
,反应中铁元素化合价降低,则做Fe2O3氧化剂,反应中氢元素化合价升高,则H2为还原剂,故答案为: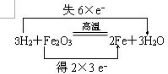 ;Fe2O3;H2;
;Fe2O3;H2;
(3)3Cu+8HNO3══3Cu(NO3)2+2NO↑+4H2O,单线桥表示电子转移方向和数目为: ,依据氧化还原反应中氧化剂的氧化性大于氧化产物得到:HNO3>Cu(NO3)2,故答案为:
,依据氧化还原反应中氧化剂的氧化性大于氧化产物得到:HNO3>Cu(NO3)2,故答案为: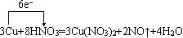 ; HNO3>Cu(NO3)2;
; HNO3>Cu(NO3)2;
Ⅲ、①3.01×1023个HCl分子的物质的量= =
=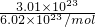 =0.5mol,故答案为:0.5mol;
=0.5mol,故答案为:0.5mol;
②标准状况下,6.72L CH4的质量=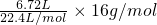 =4.8g,故答案为:4.8g;
=4.8g,故答案为:4.8g;
③将30mL 0.5mol/LNaOH溶液加水稀释到500mL,稀释后溶液中NaOH的物质的量浓度设为x,则0.03L×0.5mol/L=0.5L×x,
x=0.03mol/L,故答案为:0.03mol/L.
分析:Ⅰ、(1)以上物质中能导电需要溶液中存在自由移动的离子,固体中存在自由移动的电子;
(2)电解质是水溶液中或熔融状态下能导电的化合物;
Ⅱ、(1)依据物质的性质写出离子方程式:氧化铜难溶于水,硫酸钡是沉淀;
(2)依据氧化还原反应的概念分析判断,元素化合价升高的做还原剂,元素化合价降低的做氧化剂;双线桥法标注得到电子和失电子的方向,中的转移数目;
(3)3Cu+8HNO3══3Cu(NO3)2+2NO↑+4H2O,单线桥表示电子转移方向和数目;氧化剂的氧化性大于氧化产物;
Ⅲ、①依据n= 计算;
计算;
②依据n=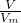 =
= 计算;
计算;
③依据稀释溶液溶质物质的量不变计算.
点评:本题考查了电解质非电解质概念应用,离子方程式的书写方法,氧化还原反应的概念应用,强弱规律的应用,电子转移标注,单线桥,双线桥表示方法,物质的量与各量的计算关系.
(1)以上物质中能导电的是④⑧,故答案为:④⑧;
(2)以上物质中属于电解质的是①③④⑧,故答案为:①③④⑧;
Ⅱ(1)①氧化铜是难溶于水的氧化物,离子方程式为:CuO+2H+=Cu2++H2O,故答案为:CuO+2H+=Cu2++H2O;
②氢氧化钡和硫酸反应生成沉淀硫酸钡和水,反应的离子方程式为:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,故答案为:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O;
(2)氢气还原三氧化二铁的反应为:Fe2O3+3H2=2Fe+3H2O;双线桥法表示为:
 ,反应中铁元素化合价降低,则做Fe2O3氧化剂,反应中氢元素化合价升高,则H2为还原剂,故答案为:
,反应中铁元素化合价降低,则做Fe2O3氧化剂,反应中氢元素化合价升高,则H2为还原剂,故答案为: ;Fe2O3;H2;
;Fe2O3;H2;(3)3Cu+8HNO3══3Cu(NO3)2+2NO↑+4H2O,单线桥表示电子转移方向和数目为:
 ,依据氧化还原反应中氧化剂的氧化性大于氧化产物得到:HNO3>Cu(NO3)2,故答案为:
,依据氧化还原反应中氧化剂的氧化性大于氧化产物得到:HNO3>Cu(NO3)2,故答案为: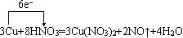 ; HNO3>Cu(NO3)2;
; HNO3>Cu(NO3)2;Ⅲ、①3.01×1023个HCl分子的物质的量=
 =
=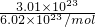 =0.5mol,故答案为:0.5mol;
=0.5mol,故答案为:0.5mol;②标准状况下,6.72L CH4的质量=
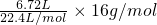 =4.8g,故答案为:4.8g;
=4.8g,故答案为:4.8g;③将30mL 0.5mol/LNaOH溶液加水稀释到500mL,稀释后溶液中NaOH的物质的量浓度设为x,则0.03L×0.5mol/L=0.5L×x,
x=0.03mol/L,故答案为:0.03mol/L.
分析:Ⅰ、(1)以上物质中能导电需要溶液中存在自由移动的离子,固体中存在自由移动的电子;
(2)电解质是水溶液中或熔融状态下能导电的化合物;
Ⅱ、(1)依据物质的性质写出离子方程式:氧化铜难溶于水,硫酸钡是沉淀;
(2)依据氧化还原反应的概念分析判断,元素化合价升高的做还原剂,元素化合价降低的做氧化剂;双线桥法标注得到电子和失电子的方向,中的转移数目;
(3)3Cu+8HNO3══3Cu(NO3)2+2NO↑+4H2O,单线桥表示电子转移方向和数目;氧化剂的氧化性大于氧化产物;
Ⅲ、①依据n=
 计算;
计算;②依据n=
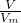 =
= 计算;
计算;③依据稀释溶液溶质物质的量不变计算.
点评:本题考查了电解质非电解质概念应用,离子方程式的书写方法,氧化还原反应的概念应用,强弱规律的应用,电子转移标注,单线桥,双线桥表示方法,物质的量与各量的计算关系.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目