题目内容
按要求回答下列问题:
(1)画出第三周期核外未成对电子最多的基态原子的价电子排布图______________;
(2)写出族序数为周期数三倍的主族元素的原子电子排布式_____________________;
(3)用价层电子对互斥模型推测下列分子或离子的空间构型及中心原子的杂化方式。
SCl2 _________、__________;BeCl2_________、_________;
(4)写出所给微粒的一种等电子体的化学式:SO2 : SO42-___________.
(1)画出第三周期核外未成对电子最多的基态原子的价电子排布图______________;
(2)写出族序数为周期数三倍的主族元素的原子电子排布式_____________________;
(3)用价层电子对互斥模型推测下列分子或离子的空间构型及中心原子的杂化方式。
SCl2 _________、__________;BeCl2_________、_________;
(4)写出所给微粒的一种等电子体的化学式:SO2 : SO42-___________.
(16分) (1) (2)1s22s2sp4
(2)1s22s2sp4
(3) V型 ; sp3 ;直线型 ;sp (4) O3; PO43-
 (2)1s22s2sp4
(2)1s22s2sp4 (3) V型 ; sp3 ;直线型 ;sp (4) O3; PO43-
试题分析:(1)第三周期核外未成对电子最多的基态原子是P元素,所以价电子排布图为
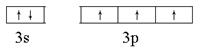 。
。(2)族序数为周期数三倍的主族元素氧元素,其原子电子排布式为1s22s2sp4。
(3)根据价层电子对互斥理论可知,SCl2和BeCl2中中心原子含有的孤对电子对数分别是(6-2×1)÷2=2、(2-2×1)÷2=0,所以分子的空间构型分别是V型、sp3杂化和直线型、sp杂化。
(4)原子数和电子式分别都相等的是等电子体,则和二氧化硫互为等电子体的是臭氧。和SO42-互为等电子体的是PO43-。
点评:该题是高考中的常见题型,试题综合性强,侧重对学生能力的培养和解题方法的指导与训练,有助于培养学生的逻辑思维能力和抽象思维能力,提高学生分析问题、解决问题的能力。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目