题目内容
2.下列关于金属腐蚀的叙述正确的是( )| A. | 金属腐蚀的实质是金属的原子失去电子变成金属离子 | |
| B. | 金属的化学腐蚀必需在酸性条件下进行 | |
| C. | 金属腐蚀的快慢与温度高低无关 | |
| D. | 钢铁在弱酸性或中性环境腐蚀时,正极上发生的反应是2H++2e-═H2↑ |
分析 A、金属腐蚀的实质是金属原子失去电子被氧化的过程;
B、金属腐蚀的条件:和空气以及水接触,在酸性条件下发生析氢腐蚀,在中性以及弱酸性腐蚀吸氧腐蚀;
C、温度高腐蚀快;
D、根据金属析氢腐蚀的原理来回答判断.
解答 解:A、金属腐蚀的实质是金属原子失去电子变为阳离子,是被氧化的过程,故A正确;
B、金属腐蚀的条件:和空气以及水接触,在酸性条件下发生析氢腐蚀,在中性以及弱酸性腐蚀吸氧腐蚀,所以不一定在酸性条件下进行,故B错误;
C、温度高腐蚀快,所以金属腐蚀的快慢与温度高低有关,故C错误;
D、在弱酸性或中性环境腐蚀时,会发生金属的吸氧腐蚀,则正极发生的反应为:2H2O+O2+4e-=4OH-,故D错误.
故选A.
点评 本题综合性较大,涉及金属腐蚀、原电池、元素化合物性质等,比较基础,旨在考查学生对基础知识的全面掌握情况.

练习册系列答案
相关题目
12.下表是元素周期表的一部分,针对表中所列①~⑩元素,填写下列空白.
(1)单质性质最不活泼的元素的原子结构示意图是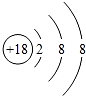 .
.
(2)地壳中含量最多的元素在元素周期表中的位置为第二周期ⅥA族.
(3)元素①的气态氢化物的化学式为CH4,其中含有的化学键的类型为极性键.
(4)第三周期元素的最高价氧化物对应水化物中,酸性最强的是HClO4(填化学式,下同),具有两性的是Al(OH)3.
(5)元素⑦的氧化物与氢氧化钠溶液反应的产物是NaAlO2和H2O.
(6)用电子式表示元素⑤与④的化合物的形成过程: .
.
| 周期 族 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ③ | ④ | ||||
| 三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
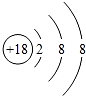 .
.(2)地壳中含量最多的元素在元素周期表中的位置为第二周期ⅥA族.
(3)元素①的气态氢化物的化学式为CH4,其中含有的化学键的类型为极性键.
(4)第三周期元素的最高价氧化物对应水化物中,酸性最强的是HClO4(填化学式,下同),具有两性的是Al(OH)3.
(5)元素⑦的氧化物与氢氧化钠溶液反应的产物是NaAlO2和H2O.
(6)用电子式表示元素⑤与④的化合物的形成过程:
 .
.
13.下列实验设计不能达到实验目的是( )
| A. | 用燃着的木条区分氧气和二氧化碳 | |
| B. | 用盐酸除去石灰水中的少量CaCO3 | |
| C. | 用盐酸除去铁钉表面的少量铁锈 | |
| D. | 用盐酸验证敞口放置的NaOH溶液已变质 |
17.如表为某汽车在不同速率时所产生的空气污染物质量(按汽车平均行驶1公里计算).
根据表格,下列说法不正确的是( )
| 污染物/g•km-1 | 速率/km•h-1 | ||
| 50 | 80 | 120 | |
| 一氧化碳 | 8.7 | 5.4 | 9.6 |
| 氮的氧化物 | 0.6 | 1.5 | 3.8 |
| 碳氢化合物 | 0.7 | 0.6 | 0.8 |
| A. | 汽车行驶时,污染物中CO含量最高 | |
| B. | 汽车速率为120km•h-1时,污染最严重 | |
| C. | 从环保角度考虑,最合适的汽车速率为50km•h-1 | |
| D. | 汽车速率增大时,产生的氮的氧化物也随之增多 |
7.某溶液中含有Ag+、Ba2+、Mg2+离子,为了将这三种离子逐个沉淀分离,加入下列离子的先后顺序正确的是( )
| A. | CO32-、Cl-、OH- | B. | Cl-、CO32-、OH- | C. | OH-、Cl-、CO32- | D. | Cl-、OH-、CO32- |
14.常温下,pH=2的一元弱酸HA溶液与0.01mol/L的一元碱BOH溶液(BOH溶液中c(OH-):c(H+)=1×1010)两种溶液等体积混合后,得到的溶液中各离子浓度大小关系正确的是( )
| A. | c(OH-)>c(H+)>c(B+)>c(A-) | B. | c(B+)=c(A-) c(H+)>c(OH-) | ||
| C. | c(B+)>c(A-)>c(OH-)>c(H+) | D. | c(A-)>c(B+)>c(H+)>c(OH-) |
11.下列有关醛的判断正确的是( )
| A. | 用溴水检验CH2=CH-CHO中是否含有碳碳双键 | |
| B. | 1mol醛发生银镜反应最多生成2molAg | |
| C. | 对甲基苯甲醛( )使高锰酸钾酸性溶液褪色,说明它含醛基 )使高锰酸钾酸性溶液褪色,说明它含醛基 | |
| D. | 能发生银镜反应的有机物不一定是醛类 |
12.下列变化过程中△H<0的是( )
| A. | Na与水反应 | B. | HCl分解为H2和Cl2 | ||
| C. | 电解Al2O3得到Al和O2 | D. | Ba(OH)2•8H2O与NH4Cl晶体混合反应 |