题目内容
 电化学在工业生产中有广泛应用.
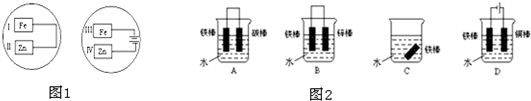
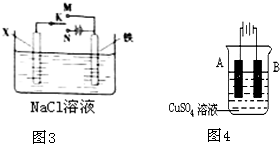
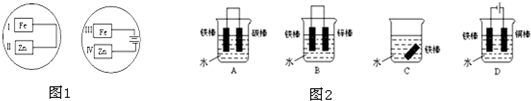
电化学在工业生产中有广泛应用.(一)如图1所示,水槽中试管内有一枚铁钉,放置数天观察,发现铁钉被腐蚀.
(1)若试管内液面上升,发生
吸氧
吸氧
腐蚀,电极反应为负极:Fe-2e-+2OH-═Fe(OH)2
Fe-2e-+2OH-═Fe(OH)2
;正极:O2+2H2O+4e-═4OH-
O2+2H2O+4e-═4OH-
.(2)若试管内液面下降,则烧杯中的溶液呈
强酸
强酸
性,正极的电极反应为:2H++2e-═H2↑
2H++2e-═H2↑
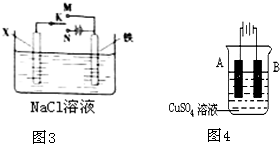
.(二)如图2为相互串联的甲、乙两个电解池(电极都是惰性电极),请回答:
(1)写出甲电解池中的电解总反应方程式:
2CuSO4+2H2O═2Cu+O2↑+2H2SO4
2CuSO4+2H2O═2Cu+O2↑+2H2SO4
.(2)若甲槽阴极增重12.8g,则乙槽阳极放出气体为
Cl2
Cl2
,在标准状况下的体积为4.48L
4.48L
;检验该气体一般用湿润的淀粉-KI试纸,现象是试纸变蓝
试纸变蓝
,发生的反应是Cl2+2I-═I2+2Cl-
Cl2+2I-═I2+2Cl-
.(3)若乙槽剩余液体为400mL,则电解后得到碱液的物质的量浓度为
1mol/L
1mol/L
;电解过程中,乙槽溶液pH的变化为(“升高”、“降低”或“不变”)升高
升高
.分析:(一)图1中,铁钉含有的碳、铁和电解质溶液构成原电池,如果试管内液面上升,则说明发生吸氧腐蚀,如果试管内液面下降,则说明发生析氢腐蚀,在中性或弱酸性溶液中,铁钉发生吸氧腐蚀,在强酸性溶液中铁钉发生析氢腐蚀;
(二)(1)甲电解池中,阳极上氢氧根离子放电生成氧气,阴极上铜离子放电生成铜,据此写出电池反应式;
(2)乙槽中,阳极上氯离子放电,阴极上氢离子放电,根据转移电子相等计算生成氯气的体积;用淀粉碘化钾试纸检验氯气,氯气能置换出碘,碘遇淀粉变蓝色;
(3)根据转移电子和氢氧化钠的关系式计算氢氧化钠的浓度,根据溶液中氢氧根离子浓度变化确定溶液酸碱性变化.
(二)(1)甲电解池中,阳极上氢氧根离子放电生成氧气,阴极上铜离子放电生成铜,据此写出电池反应式;
(2)乙槽中,阳极上氯离子放电,阴极上氢离子放电,根据转移电子相等计算生成氯气的体积;用淀粉碘化钾试纸检验氯气,氯气能置换出碘,碘遇淀粉变蓝色;
(3)根据转移电子和氢氧化钠的关系式计算氢氧化钠的浓度,根据溶液中氢氧根离子浓度变化确定溶液酸碱性变化.
解答:解:(一)(1)铁钉含有的碳、铁和电解质溶液构成原电池,如果试管内液面上升,则说明发生吸氧腐蚀,负极上铁失电子生成亚铁离子,亚铁离子和氢氧根离子反应生成氢氧化亚铁,所以电极反应式为:Fe-2e-+2OH-═Fe(OH)2,正极上氧气得电子生成氢氧根离子,电极反应式为:O2+2H2O+4e-═4OH-,
故答案为:吸氧;Fe-2e-+2OH-═Fe(OH)2;O2+2H2O+4e-═4OH-;
(2)铁钉含有的碳、铁和电解质溶液构成原电池,如果试管内液面下降,则说明发生析氢腐蚀,在强酸性溶液中,铁钉发生析氢腐蚀,正极上氢离子得电子生成氢气,电极反应式为:2H++2e-═H2↑,
故答案为:强酸;2H++2e-═H2↑;
(二)(1)甲装置中,电极都是惰性电极,所以电解硫酸铜溶液时,阳极上氢氧根离子放电生成氧气,阴极上铜离子放电生成铜,所以电池反应式为:2CuSO4+2H2O═2Cu+O2↑+2H2SO4,故答案为:2CuSO4+2H2O═2Cu+O2↑+2H2SO4;
(2)乙槽中阳极上氯离子放电生成氯气,串联电解池中转移电子数相等,析出n(Cu)=n(Cl2),所以阳极上氯气的体积=
mol×22.4L/mol=4.48L;
氯气有强氧化性,能置换出碘化钾中的碘,碘遇淀粉变蓝色,所以湿润的淀粉碘化钾试纸变蓝,反应的离子方程式为:Cl2+2I-═I2+2 Cl-,
故答案为:Cl2;4.48L;试纸变蓝;Cl2+2I-═I2+2 Cl-;
(3)设氢氧化钠的物质的量浓度是xmol/L,
2NaCl+2H2O
H2↑+2NaOH+Cl2↑ 转移电子
2mol 2mol
0.4xmol
mol×2
x=
=1,
所以氢氧化钠的物质的量浓度是1.0mol/L,电解过程中,乙槽中生成的氢氧化钠逐渐增大,则溶液的pH逐渐升高,
故答案为:1mol/L;升高.
故答案为:吸氧;Fe-2e-+2OH-═Fe(OH)2;O2+2H2O+4e-═4OH-;
(2)铁钉含有的碳、铁和电解质溶液构成原电池,如果试管内液面下降,则说明发生析氢腐蚀,在强酸性溶液中,铁钉发生析氢腐蚀,正极上氢离子得电子生成氢气,电极反应式为:2H++2e-═H2↑,
故答案为:强酸;2H++2e-═H2↑;
(二)(1)甲装置中,电极都是惰性电极,所以电解硫酸铜溶液时,阳极上氢氧根离子放电生成氧气,阴极上铜离子放电生成铜,所以电池反应式为:2CuSO4+2H2O═2Cu+O2↑+2H2SO4,故答案为:2CuSO4+2H2O═2Cu+O2↑+2H2SO4;
(2)乙槽中阳极上氯离子放电生成氯气,串联电解池中转移电子数相等,析出n(Cu)=n(Cl2),所以阳极上氯气的体积=
| 12.8 |
| 64 |
氯气有强氧化性,能置换出碘化钾中的碘,碘遇淀粉变蓝色,所以湿润的淀粉碘化钾试纸变蓝,反应的离子方程式为:Cl2+2I-═I2+2 Cl-,
故答案为:Cl2;4.48L;试纸变蓝;Cl2+2I-═I2+2 Cl-;
(3)设氢氧化钠的物质的量浓度是xmol/L,
2NaCl+2H2O
| ||
2mol 2mol
0.4xmol
| 12.8 |
| 64 |
x=
| ||
| 2mol×0.4mol |
所以氢氧化钠的物质的量浓度是1.0mol/L,电解过程中,乙槽中生成的氢氧化钠逐渐增大,则溶液的pH逐渐升高,
故答案为:1mol/L;升高.
点评:本题考查金属的腐蚀与防护及电解池原理,注意根据电解质溶液的酸碱性确定钢铁发生腐蚀的类型,为易错点.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 (2011?济南三模)电化学原理广泛用于工业生产中,如有一种电化学净水法的原理是:在电解过程中将低价金属离子(如Co2+)氧化成高价态的离子(Co3+),然后以此高价态的金属离子作氧化剂把废水中的有机物氧化成CO2而净化.实验室用如图装置模拟上述过程,下列说法正确的是( )
(2011?济南三模)电化学原理广泛用于工业生产中,如有一种电化学净水法的原理是:在电解过程中将低价金属离子(如Co2+)氧化成高价态的离子(Co3+),然后以此高价态的金属离子作氧化剂把废水中的有机物氧化成CO2而净化.实验室用如图装置模拟上述过程,下列说法正确的是( )