题目内容
【题目】E、F、D、X、Y、Z为前四周期元素,且原子序数依次增大。E的最高正价和最低负价的绝对值相等,F有三个能级,且每个能级上的电子数相等,D原子未成对电子数在同周期元素中最多,X与D同周期,第一电离能比D低,Y与F同主族,Z的最外层只有一个电子,其它电子层电子均处于饱和状态。请回答下列问题:
(1)Y原子基态核外电子排布式为__________;基态Z原子中电子占据的最高能层符号为_________。
(2)F、D、X的电负性由小到大的顺序为__________(用元素符号表示)。
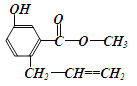
(3)E、F、D、X形成的有机物FX(DE2)2中F的杂化轨道类型为____________,DX3-离子的立体构型是___________。
(4)下列关于F2E2分子和E2X2分子的说法正确的是________。
a.分子中都含σ键和π键 b.F2E2分子的沸点明显低于E2X2分子
c.都是含极性键和非极性键的非极性分子 d.互为等电子体
(5)将Z单质的粉末加入到DE3的浓溶液中,并通入X2,充分反应后溶液呈深蓝色,该反应的离子方程式为________。
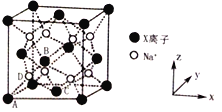
(6)X和Na的一种离子化合物的晶胞结构如图,该离子化合物为_________(填化学式)。Na+的配位数为_________。晶胞有两种基本要素,一种是原子坐标参数,表示晶胞内部各原子的相对位置,其中原子坐标参数A为(0,0,0);B为(![]() ,0,
,0, ![]() ),C为(
),C为(![]() ,
, ![]() ,0),则D原子的坐标参数为________。另外一种是晶胞参数,如已知该晶胞的密度为ρg cm-3,阿伏加德罗常数为NA,则两个最近的X离子间距离为________nm(用含ρ、NA的计算式表示)。
,0),则D原子的坐标参数为________。另外一种是晶胞参数,如已知该晶胞的密度为ρg cm-3,阿伏加德罗常数为NA,则两个最近的X离子间距离为________nm(用含ρ、NA的计算式表示)。
【答案】 1s22s22p63s23p2 N C<N<O sp2 平面三角形 b 2Cu+8NH3+O2+2H2O=2[Cu(NH3)4]2++4OH- Na2O 4 (1/4,1/4,1/4) ![]()
【解析】E、F、D、X、Y、Z为前四周期元素,且原子序数依次增大。F有三个能级,且每个能级上的电子数相等,核外电子排布为1s22s22p2,故F为C元素;E的最高正价和最低负价的绝对值相等,则E为H元素;Y与F同主族,Y为Si,D原子未成对电子数在同周期元素中最多,则外围电子排布为ns2np3,则D为N元素;X与D同周期,第一电离能比D低,则X为O元素;Z的最外层只有一个电子,其他电子层电子均处于饱和状态,不可能为短周期元素,原子序数小于30,故核外电子排布为1s22s22p63s23p63d104s1,则Z为Cu元素。
(1)Y为Si,Si核外电子排布式为:1s22s22p63s23p2,Z为Cu元素,原子中电子占据的最高能层符号为N,故答案为:1s22s22p63s23p2;N;
(2)同一周期,从左到右,元素的电负性逐渐增大,C、N、O的电负性由小到大的顺序为C<N<O,故答案为:C<N<O;
(3)H、C、N、O形成的有机物CO(NH2)2,分子中C原子形成3个σ键,没有孤电子对,C原子采取sp2杂化; NO3-离子的立体构型是平面三角形,故答案为:sp2;平面三角形;
(4)F2E2分子和E2X2分子分别为C2H2分子和H2O2分子。a.H2O2分子中只含σ键,故b错误;b.H2O2分子分子间存在氢键,其沸点明显高于C2H2分子,故正确;c.过氧化氢是含极性键和非极性键的极性分子,故错误;d.两者价电子总数不等,不是互为等电子体,故错误;故选b;(5)将Cu单质的粉末加入到NH3的浓溶液中,并通入O2,充分反应后溶液呈深蓝色,反应生成[Cu(NH3)4]2+,该反应的离子方程式为:2Cu+8NH3+O2+2H2O=2[Cu(NH3)4]2++4OH-,故答案为:2Cu+8NH3+O2+2H2O=2[Cu(NH3)4]2++4OH-;
(6)晶胞中Na+离子数目为8,O2-离子数目为8×![]() +6×
+6×![]() =4,Na+离子、O2-离子数目之比为2:1,故该晶体化学式为Na2O,由图可知,每个Na+离子周围有4个O2-离子,Na+离子配位数为4;根据原子坐标参数A为(0,0,0),说明A为坐标原点,B为(
=4,Na+离子、O2-离子数目之比为2:1,故该晶体化学式为Na2O,由图可知,每个Na+离子周围有4个O2-离子,Na+离子配位数为4;根据原子坐标参数A为(0,0,0),说明A为坐标原点,B为(![]() ,0,
,0, ![]() ),C为(
),C为(![]() ,
, ![]() ,0),则D原子的坐标参数为(
,0),则D原子的坐标参数为(![]() ,
, ![]() ,
, ![]() );面心O2-离子与顶点O2-离子距离最近,晶胞质量为
);面心O2-离子与顶点O2-离子距离最近,晶胞质量为![]() g,该晶胞的密度为ρgcm-3,而晶胞体积为
g,该晶胞的密度为ρgcm-3,而晶胞体积为![]() g÷ρgcm-3=
g÷ρgcm-3=![]() cm3,晶胞棱长为
cm3,晶胞棱长为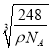 cm,则两个最近的W离子间距离为
cm,则两个最近的W离子间距离为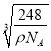 ×
×![]() cm=
cm=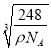 ×
×![]() ×10-7nm,故答案为:Na2O;4;(
×10-7nm,故答案为:Na2O;4;(![]() ,
, ![]() ,
, ![]() );
); 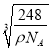 ×
×![]() ×10-7nm。
×10-7nm。