题目内容
【题目】已知由短周期常见元素形成的纯净物A、B、C、D转化关系如图1琐事,物质A与物质B之间的反应不再溶液中进行。
若A为金属单质,C是淡黄色固体,D是一元强碱。
①物质B是__________(填化学式)。
②化合物C的电子式为_________;化合物D中所含化学键的类型是_________。
③在常温下,向PH=a的醋酸溶液中加入等体积pH=b的D溶液,且a+b=14,则充分反应后,所得溶液中各种离子的浓度由大到小的顺序是:__________.
(2)若A为非金属单质,C是有色气体,D是一元强酸.
①B为__________(填化学式)。
②化合物C与H2O反应化学方程式___________,氧化剂与还原剂的量比为_________。
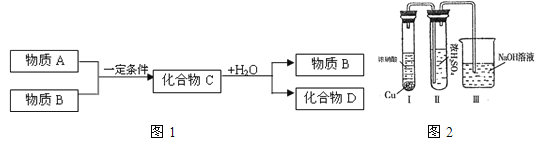
(3)某同学用图2装置完成有关探究实验。
Ⅰ试管中发生反应的离子方程式为__________。
Ⅱ试管中观察到__________的实验现象时,说明NO2能溶于浓硫酸中,浓硫酸不能干燥NO2。
【答案】(1)①O2;
②![]() ;Na2O2、离子键和共价键
;Na2O2、离子键和共价键
③c(CH3COO-)>c(Na+)>c(H+)>c(OH-);
(2)①NO
②3NO2+H2O==2HNO3+NO;1:2
(3)Cu+4H++2NO3-=Cu2++2NO2↑+2H2O;浓H2SO4中未发现有气体逸出,且浓H2SO4
【解析】
试题解析:(1)若A为金属单质,C是淡黄色固体,应为Na2O2,则A为Na,D是一元强碱,应为NaOH,则①A为Na,结构示意图为![]() ,②C为Na2O2,为离子化合物为,电子式为
,②C为Na2O2,为离子化合物为,电子式为![]() ,化合物D为NaOH:含离子键和共价键;③D为NaOH,与等物质的量醋酸反应生成CH3COONa,为强碱弱酸盐,溶液呈碱性,pH>7,若在常温下,向pH=a的醋酸溶液中加入等体积pH=b的NaOH溶液,且a+b=14,则有
,化合物D为NaOH:含离子键和共价键;③D为NaOH,与等物质的量醋酸反应生成CH3COONa,为强碱弱酸盐,溶液呈碱性,pH>7,若在常温下,向pH=a的醋酸溶液中加入等体积pH=b的NaOH溶液,且a+b=14,则有 ,解之得:c(H+)=c(OH-),而醋酸为弱酸,则醋酸过量,反应后溶液呈酸性,则有c(CH3COO-)>c(Na+),c(H+)>c(OH-)且c(Na+)>c(H+),所以c(CH3COO-)>c(Na+)>c(H+)>c(OH-),(2)C是有色气体,应为NO2,A为非金属单质,应为O2,则B为NO,D为HNO3,则①NO和O2反应生成NO2,反应的化学方程式为2NO+O2=2NO2,故答案为:2NO+O2=2NO2;②3NO2+H2O=2HNO3+NO; 氧化剂与还原剂的量比为1:2; (3)金属铜与浓硝酸反应生成二氧化氮气体;Cu + 4H+ + 2NO3- = Cu2+ + 2NO2↑+ 2H2O;浓H2SO4中未发现有气体逸出,且浓H2SO4溶液的颜色发生变化由无色变为红棕色,说明NO2能溶于浓硫酸中;
,解之得:c(H+)=c(OH-),而醋酸为弱酸,则醋酸过量,反应后溶液呈酸性,则有c(CH3COO-)>c(Na+),c(H+)>c(OH-)且c(Na+)>c(H+),所以c(CH3COO-)>c(Na+)>c(H+)>c(OH-),(2)C是有色气体,应为NO2,A为非金属单质,应为O2,则B为NO,D为HNO3,则①NO和O2反应生成NO2,反应的化学方程式为2NO+O2=2NO2,故答案为:2NO+O2=2NO2;②3NO2+H2O=2HNO3+NO; 氧化剂与还原剂的量比为1:2; (3)金属铜与浓硝酸反应生成二氧化氮气体;Cu + 4H+ + 2NO3- = Cu2+ + 2NO2↑+ 2H2O;浓H2SO4中未发现有气体逸出,且浓H2SO4溶液的颜色发生变化由无色变为红棕色,说明NO2能溶于浓硫酸中;

【题目】从某废液(含有Fe2+、Cu2+、Cl-)中回收铜并制得纯净的FeCl3溶液。现以制得纯净的FeCl3溶液为原料制取优良的水处理剂高铁酸钾(K2FeO4),其流程如下:

已知:高锰酸钾(K2FeO4)位暗紫色固体,可溶于水。在中性或酸性溶液中逐渐分解,在碱性溶液中稳定。高锰酸钾具有强氧化性。高锰酸钾(K2FeO4)与水作用产生Fe(OH)3。
(1)检验废液中含有Fe2+选用的试剂是________(填化学式);从废液中制得纯净的FeCl3溶液加入的试剂除铁粉外,还需要一种试剂是_________(填化学式),加入时发生反应的离子方程式为__________。
(2)高锰酸钾(K2FeO4)在处理水过程中的作用是_________和__________。
(3)“氧化”过程反应的离子方程式为__________。
(4)过滤时需用的玻璃仪器有玻璃棒、烧杯和________,上述工艺得到的高锰酸钾常含有杂志,可用重结晶法提纯,操作是:将粗产品用_________溶解,然后________。
(5)用回收的铜为原料可制得粗制CuSO4·5H2O晶体(含有少量的FeSO4·7H2O),除去CuSO4·5H2O晶体中杂志的方法是:向溶液中加入H2O2,再调解溶液PH,过滤即可制得纯净的CuSO4溶液,进而制得纯净CuSO4·5H2O的晶体。
已知:室温时一些物质的Kaq如下表:
化学式 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
Kaq | 8.0×10-16 | 8.0×10-18 | 8.0×10-20 |
已知溶液中的离子浓度小于1×10-6mol·L-1时就认定沉淀完全。
加双氧水的目的是__________;若溶液中CuSO4的浓度为3.0mol·L-1,通过计算说明此方法可除去粗制CuSO4·5H2O晶体中FeSO4·7H2O的理由________。