题目内容
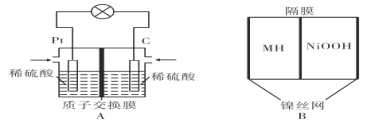
【题目】氢能是一种新型能源,氢氧燃料电池的能量转化效率高。某学习小组设计如图A所示的氢氧燃料电池装置,电流由石墨极(C极)经外电路流向铂极(Pt极)。
请回答下列问题:
(1)向图A装置中充入氢气的一极是____(填“铂极”或“石墨极”),电子流向是________
(2)A装置在能量转化过程中,负极的电极反应式为________
(3)若A装置消耗11.2L氧气(标准状况),理论上有____molH+从交换膜________侧向________侧迁移(填“左”或“右”)。
(4)某金属合金是优质储氢材料,金属氢化物镍电池(MH-Ni电池)具有广泛应用价值。如图B以KOH为电解质,电池反应为NiOOH+MH![]() Ni(OH)2+M。在放电时正极的电极反应式为________。
Ni(OH)2+M。在放电时正极的电极反应式为________。
【答案】铂极 由铂极流出经外电路流向石墨极 H2-2e-=2H+ 2 左 右 NiOOH+e-+H2O=Ni(OH)2+OH-
【解析】
装置A为燃料电池,燃料电池中,通入燃料的一极为负极,通入空气或氧气的一极为正极,则氢氧燃料电池中,通入燃料氢气的一极为负极,电极反应为:H2-2e-=2H+,通入氧气的一极为正极,电极反应为:O2+4e-+4H+=2H2O,原电池中,电流由正极流向负极,电子的流向与电流方向相反,据此分析解答;
装置B为金属氢化物镍电池(MH-Ni电池),根据电池总反应电池反应为NiOOH+MH![]() Ni(OH)2+M,放电时,正极得电子,发生还原反应,据此分析解答。
Ni(OH)2+M,放电时,正极得电子,发生还原反应,据此分析解答。
(1)根据分析,氢氧燃料电池中,通入燃料氢气的一极为负极,原电池中,电流由正极流向负极,已知电流由石墨极(C极)经外电路流向铂极(Pt极),则石墨极(C极)为正极,铂极(Pt极)负极,则A中充入氢气的一极是铂极,电子流向与电流的方向相反,则电流是由铂极流出经外电路流向石墨极;
(2)因为电解质为硫酸,所以,A装置在能量转化过程中,负极的电极反应式为H2-2e-=2H+;
(3)根据电极反应:O2+4e-+4H+=2H2O、H2-2e-=2H+,消耗1mol即标况下22.4L氧气,转移4mol电子,产生4molH+,则A装置消耗11.2L氧气(标准状况),理论上负有2molH+产生,而正极消耗2molH+,并且使用的是质子交换膜,则有2molH+从交换膜左侧向右侧迁移;
(4)原电池放电时,正极得电子,发生还原反应,根据电池总反应电池反应为NiOOH+MH![]() Ni(OH)2+M可知,Ni元素由+4价变为+2价,得电子被还原,则正极的电极反应式为NiOOH+e-+H2O=Ni(OH)2+OH-。
Ni(OH)2+M可知,Ni元素由+4价变为+2价,得电子被还原,则正极的电极反应式为NiOOH+e-+H2O=Ni(OH)2+OH-。