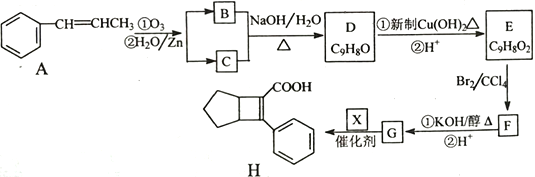
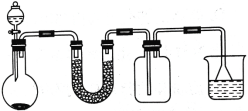
题目内容
【题目】短周期主族元素 W、X、Y、Z的原子序数依次增大,X 的最外层电子数是电子层数的2倍,Y和Z位于同一主族。甲、乙、丙为其中三种元素对应的单质,m、n、p均为由这些元素组成的二元化合物, n是一种二元弱酸。上述物质的转化关系如图所示(反应条件省略) 。下列说法正确的是

A.原子半径:W < X < Y
B.W与X组成的化合物中可能含有极性键和非极性键
C.Y与Z组成的化合物一定有漂白性
D.W与X、Y、Z组成的简单化合物的稳定性:X > Y > Z
【答案】B
【解析】
短周期主族元素W、X、Y、Z的原子序数依次增大,X的最外层电子数是电子层数的2倍,X应为C元素,不能是S元素,因为比S原子序数大的短周期主族元素只有Cl,不符合;n是一种二元弱酸,且为二元化合物,则n应为氢化物,结合物质的转化关系,可推得n为H2S,p为SO2,m为H2O,丙为S,甲为H2,乙为O2,则W为H元素,Y为O元素,Z为S元素,据此分析解答。
由以上分析知,W为H元素,X为C元素,Y为O元素,Z为S元素,
A. 同周期元素原子从左至右,原子半径以此减小,则原子半径:W < Y< X,故A错误;
B. W为H元素,X为C元素,二者组成的化合物,如乙烷等,同时含有极性键和非极性键,故B正确;
C. Y为O元素,Z为S元素,二者组成的化合物中,二氧化硫具有漂白性,而三氧化硫不具有漂白性,故C错误;
D. 非金属性越强,其对应的简单氢化物越稳定,非金属性:O>S>C,则W与X、Y、Z组成的简单化合物的稳定性:Y>Z>X,故D错误;
故选B。

练习册系列答案
 优百分课时互动系列答案
优百分课时互动系列答案
相关题目