题目内容
(2013?保定一模)已知:A为淡黄色固体,E、X常温下为气体,A、B、C、D含有相同的 金属离子,其转化关系如图(部分产物已略去).

请回答下列问题:
(1)常温常压下,3.9gA与足量的氷充分反应放出热量akJ,写出该反应的热化学方程式
(2)向500mL0.3mol/L的B溶液中缓慢通入2.24L(标准状况下)的气体X,则 所得混合溶液中各离子浓度由大到小的顺序是
(3)已知20℃时的溶解度:“S(Na2CO3)=21.2g,S(NaHCO3)=9.6g”.则20℃恒 温条件下向121.2g饱和碳酸钠溶液中通入足量的CO2气体,理论上可以析出 NaHCO3
(4)现有甲、乙两瓶无色溶液,已知它们可能是以下四种溶液:MgCl2溶液、AlCl3溶液、NaOH溶液、氨水中的两种,现做如下实验:
①取440mL甲与120mL乙反应,产生1.56g白色沉淀M
②取440mL乙与120mL甲反应,也产生1.56g白色沉淀M
③取120mL甲溶液与400mL乙溶液反应,则产生3.12g白色沉淀M;
通过必要的计算和推理判定:甲溶液为

请回答下列问题:
(1)常温常压下,3.9gA与足量的氷充分反应放出热量akJ,写出该反应的热化学方程式
2Na2O2(s)+2H2O(l)=4NaOH+O2(g)△H=-4akJ/mol
2Na2O2(s)+2H2O(l)=4NaOH+O2(g)△H=-4akJ/mol
(2)向500mL0.3mol/L的B溶液中缓慢通入2.24L(标准状况下)的气体X,则 所得混合溶液中各离子浓度由大到小的顺序是
c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
(3)已知20℃时的溶解度:“S(Na2CO3)=21.2g,S(NaHCO3)=9.6g”.则20℃恒 温条件下向121.2g饱和碳酸钠溶液中通入足量的CO2气体,理论上可以析出 NaHCO3
24.3
24.3
g (小数点后保留1位).(4)现有甲、乙两瓶无色溶液,已知它们可能是以下四种溶液:MgCl2溶液、AlCl3溶液、NaOH溶液、氨水中的两种,现做如下实验:
①取440mL甲与120mL乙反应,产生1.56g白色沉淀M
②取440mL乙与120mL甲反应,也产生1.56g白色沉淀M
③取120mL甲溶液与400mL乙溶液反应,则产生3.12g白色沉淀M;
通过必要的计算和推理判定:甲溶液为
AlCl3
AlCl3
溶液,乙溶液为NaOH
NaOH
溶液.分析:A为淡黄色固体,能和水反应,则A是Na2O2,过氧化钠和水反应生成氢氧化钠和氧气,E常温下为气体,则E是O2,B是NaOH,X是气体,能和氢氧化钠反应生成两种不同物质,X是酸性氧化物,A、B、C、D含有相同的 金属离子,都含有钠离子,X为CO2,C是Na2CO3,D是NaHCO3,根据物质间的反应来分析解答.
解答:解:A为淡黄色固体,能和水反应,则A是Na2O2,过氧化钠和水反应生成氢氧化钠和氧气,E常温下为气体,则E是O2,B是NaOH,X是气体,能和氢氧化钠反应生成两种不同物质,X是酸性氧化物,A、B、C、D含有相同的 金属离子,都含有钠离子,X为CO2,C是Na2CO3,D是NaHCO3,
(1)常温常压下,3.9gNa2O2与足量的氷充分反应放出热量akJ,3.9g过氧化钠的物质的量=
=0.05mol,则2mol过氧化钠与足量水反应放出热量为4akJ,则该反应的热化学方程式为:2Na2O2(s)+2H2O(l)=4NaOH+O2(g)△H=-4akJ/mol,
故答案为:2Na2O2(s)+2H2O(l)=4NaOH+O2(g)△H=-4akJ/mol;
(2)n(NaOH)=0.3mol/L×0.5L=0.15mol,n(CO2)=
=0.1mol,氢氧化钠和二氧化碳的物质的量之比为3:2,1<
<2,所以溶液中的溶质为等量的NaHCO3、Na2CO3,碳酸根离子水解程度大于碳酸氢根离子水解程度,钠离子不水解,所以溶液呈碱性,溶液中离子浓度大小顺序是:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),
故答案为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);
(3)20℃时,根据碳酸钠的溶解度知,121.2g饱和碳酸钠溶液中碳酸钠的质量为21.2g,溶剂的质量是100g,100g水中溶解碳酸氢钠的质量为9.6g,根据钠原子守恒知,生成碳酸氢钠的质量=
×2×84g/mol═33.6g,根据Na2CO3+H2O+CO2=2NaHCO3知,21.2g碳酸钠参加反应需要水的质量=
×18g/mol=3.6g,所以溶剂的质量为100g-3.6g=96.4g,
溶解碳酸氢钠的质量=
×96.4g=9.3g,所以析出碳酸氢钠的质量=33.6g-9.3g=24.3g,
故答案为:24.3;
(4)根据这几个反应现象知,沉淀能溶于另一种溶液中,则该沉淀为氢氧化铝,另一种物质为强碱,所以这两种溶液是氯化铝和氢氧化钠溶液,根据②③反应现象知,当乙的量增加时,沉淀会溶解,所以乙是NaOH,甲是AlCl3,
故答案为:AlCl3;NaOH.
(1)常温常压下,3.9gNa2O2与足量的氷充分反应放出热量akJ,3.9g过氧化钠的物质的量=
| 3.9g |
| 78g/mol |
故答案为:2Na2O2(s)+2H2O(l)=4NaOH+O2(g)△H=-4akJ/mol;
(2)n(NaOH)=0.3mol/L×0.5L=0.15mol,n(CO2)=
| 2.24L |
| 22.4L/mol |
| n(NaOH) |
| n(CO2) |
故答案为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);
(3)20℃时,根据碳酸钠的溶解度知,121.2g饱和碳酸钠溶液中碳酸钠的质量为21.2g,溶剂的质量是100g,100g水中溶解碳酸氢钠的质量为9.6g,根据钠原子守恒知,生成碳酸氢钠的质量=
| 21.2g |
| 106g/mol |
| 21.2g |
| 106g/mol |
溶解碳酸氢钠的质量=
| 9.6g |
| 100g |
故答案为:24.3;
(4)根据这几个反应现象知,沉淀能溶于另一种溶液中,则该沉淀为氢氧化铝,另一种物质为强碱,所以这两种溶液是氯化铝和氢氧化钠溶液,根据②③反应现象知,当乙的量增加时,沉淀会溶解,所以乙是NaOH,甲是AlCl3,
故答案为:AlCl3;NaOH.
点评:本题考查物质间的反应,正确推断物质是解本题关键,同时考查学生分析问题、解决问题的能力,难点是离子浓度大小的判断,易错点是(3),注意该反应中水参加反应导致溶剂的质量减少,则溶液中溶解的碳酸氢钠质量较少,很多同学往往认为溶剂的质量仍然是100g而导致错误,为易错点.

练习册系列答案
相关题目
 H2SiO3+2OH-(或SiO32-+H2O
H2SiO3+2OH-(或SiO32-+H2O HSiO3-+OH-,HSiO3-+H2O
HSiO3-+OH-,HSiO3-+H2O H2SiO3+OH-,AlO2-+H2O
H2SiO3+OH-,AlO2-+H2O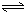 Al(OH)3+OH-),降低pH值有利于平衡向正反应方向移动,当pH调到7~8时,使它们水解完全
Al(OH)3+OH-),降低pH值有利于平衡向正反应方向移动,当pH调到7~8时,使它们水解完全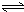 Cr2O72-+H2O
Cr2O72-+H2O