题目内容
【题目】浩瀚的海洋中蕴藏着丰富的资源。

(1)粗盐精制。
过程1除去粗盐中的Ca2+、Mg2+、![]() 杂质时,粗盐溶解后加入沉淀剂:a.过量的Na2CO3溶液b.过量的BaCl2溶液c.过量的NaOH溶液,过滤除去沉淀,再加入适量的盐酸。
杂质时,粗盐溶解后加入沉淀剂:a.过量的Na2CO3溶液b.过量的BaCl2溶液c.过量的NaOH溶液,过滤除去沉淀,再加入适量的盐酸。
①加入沉淀剂的顺序正确的是______(填序号)。
A.abc B.bac C.cba
②加入适量盐酸,反应的离子方程式有2H++![]() =H2O+CO2↑和______。
=H2O+CO2↑和______。
(2)海水提镁。
过程2中加入的试剂是______。由无水MgCl2获得Mg的化学方程式是______。
(3)海水提溴。
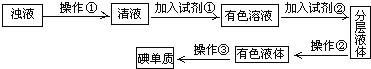
主要工业生产流程如图所示:

①海水中的Br-被Cl2氧化的离子方程式是______。
②吸收塔中SO2将Br2转化为HBr的化学方程式是______。
③工业上也可用Na2CO3溶液吸收吹出的Br2。补全以下化学方程式:___Br2+___Na2CO3+3H2O![]() ___NaBr+___NaBrO3+___NaHCO3,____________
___NaBr+___NaBrO3+___NaHCO3,____________
【答案】BC H++OH-=H2O CaO ![]() 2Br-+Cl2= Br2+2Cl- SO2+Br2+2H2O=H2SO4+2HBr 3Br2+6Na2CO3+3H2O=5NaBr+NaBrO3+6NaHCO3
2Br-+Cl2= Br2+2Cl- SO2+Br2+2H2O=H2SO4+2HBr 3Br2+6Na2CO3+3H2O=5NaBr+NaBrO3+6NaHCO3
【解析】
(1)①粗盐精制过程1除去粗盐中的Ca2+、Mg2+、![]() 杂质时,加入过量的Na2CO3溶液的目的是除去Ca2+的同时除去过量的Ba2+;
杂质时,加入过量的Na2CO3溶液的目的是除去Ca2+的同时除去过量的Ba2+;
②加入适量盐酸,剩余的碳酸钠和盐酸反应、剩余的氢氧化钠和盐酸反应;
(2)过程2中氢氧化钙和氯化镁反应生成氢氧化镁沉淀。电解熔融的MgCl2生成Mg和氯气;
(3)①海水中的Br-被Cl2氧化为溴单质;
②吸收塔中SO2和Br2反应生成HBr和硫酸;;
③根据得失电子守恒、元素守恒配平Na2CO3溶液吸收吹出的Br2的化学方程式;
(1)①粗盐精制过程1,加入Na2CO3除去Ca2+、加入NaOH溶液除去Mg2+、加入BaCl2溶液除去![]() ,加入过量的Na2CO3溶液的目的是除去Ca2+的同时除去过量的Ba2+;所以加入BaCl2溶液后再加Na2CO3溶液,加入试剂的顺序是NaOH溶液、BaCl2溶液、Na2CO3溶液,或BaCl2溶液、Na2CO3溶液、NaOH溶液,选BC;
,加入过量的Na2CO3溶液的目的是除去Ca2+的同时除去过量的Ba2+;所以加入BaCl2溶液后再加Na2CO3溶液,加入试剂的顺序是NaOH溶液、BaCl2溶液、Na2CO3溶液,或BaCl2溶液、Na2CO3溶液、NaOH溶液,选BC;
②加入适量盐酸,剩余的碳酸钠和盐酸反应2H++![]() =H2O+CO2↑、剩余的氢氧化钠和盐酸反应H++OH-=H2O;
=H2O+CO2↑、剩余的氢氧化钠和盐酸反应H++OH-=H2O;
(2)过程2中加入CaO, CaO和水反应生成氢氧化钙,氢氧化钙和氯化镁反应生成氢氧化镁沉淀,加入的试剂是CaO。电解熔融的MgCl2生成Mg和氯气,反应方程式是![]() ;
;
(3)①海水中的Br-被Cl2氧化为溴单质,反应的离子方程式是2Br-+Cl2= Br2+2Cl-;
②吸收塔中SO2和Br2反应生成HBr和硫酸,化学方程式是SO2+Br2+2H2O=H2SO4+2HBr;
③根据得失电子守恒、元素守恒配平Na2CO3溶液吸收吹出的Br2的化学方程式;3Br2+6Na2CO3+3H2O=5NaBr+NaBrO3+6NaHCO3。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案