题目内容
【题目】臭氧是地球大气中一种微量气体,人类正在保护和利用臭氧。
(1)氮氧化物会破坏臭氧层,已知:
①NO(g) + O3(g)![]() NO2(g) + O2 (g) ΔH1 = 200.9 kJ·mol1
NO2(g) + O2 (g) ΔH1 = 200.9 kJ·mol1
②2NO(g) +O2 (g)![]() 2NO2 (g) ΔH 2 = 116.2 kJ·mol1
2NO2 (g) ΔH 2 = 116.2 kJ·mol1
则反应:2O3(g)![]() 3O2 (g) ΔH=______。
3O2 (g) ΔH=______。
(2)实验室将氧气和臭氧的混合气体0.896 L(标准状况)通入盛有20.0 g铜粉的反应器中,加热充分反应后,粉末的质量变为21.6 g。则原混合气中臭氧的体积分数为______。
(3)大气中的部分碘源于O3对海水中I—的氧化。将O3持续通入NaI溶液中进行模拟研究,探究Fe2+对氧化I—反应的影响,反应体系如图1,测定两组实验中I3—浓度实验的数据如图2所示:
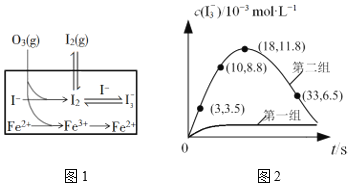
①反应后的溶液中存在化学平衡:I2(aq)+I(aq) ![]() I3-(aq),当c(I3-)/c(I-)=6.8时,溶液中c(I2)=______。(已知反应的平衡常数K=680)
I3-(aq),当c(I3-)/c(I-)=6.8时,溶液中c(I2)=______。(已知反应的平衡常数K=680)
②结合实验数据可知,Fe2+对I的转化率的影响是_____(填“增大”“无影响”或“减小”)。
③第二组实验18 s后,I3—浓度下降。导致I3—浓度下降的原因是_____。
(4)臭氧是一种杀菌消毒剂,还是理想的烟气脱硝剂。
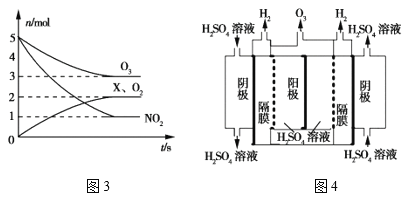
①一种脱硝反应中,各物质的物质的量随时间的变化如图3所示,X为___(填化学式)。
②一种臭氧发生装置原理如图4所示。阳极(惰性电极)的电极反应式为____。
【答案】285.6 kJ·mol 150%0.01 mol·L 1增大c(I )减小,I2 (aq)+I (aq)![]() I3 (aq) 平衡向逆反应方向移动N2O53H2O6e ==O 3 ↑+6H +
I3 (aq) 平衡向逆反应方向移动N2O53H2O6e ==O 3 ↑+6H +
【解析】
(1)已知:①NO(g) + O3(g)![]() NO2(g) + O2 (g) ΔH1 = 200.9 kJ·mol1
NO2(g) + O2 (g) ΔH1 = 200.9 kJ·mol1
②2NO(g) +O2 (g)![]() 2NO2 (g) ΔH 2 = 116.2 kJ·mol1
2NO2 (g) ΔH 2 = 116.2 kJ·mol1
根据盖斯定律,①×2-②得,2O3(g)![]() 3O2 (g) ΔH=2ΔH1-ΔH 2 =(200.9 kJ·mol1)×2-(-84.7 kJ·mol1)=285.6 kJ·mol 1,
3O2 (g) ΔH=2ΔH1-ΔH 2 =(200.9 kJ·mol1)×2-(-84.7 kJ·mol1)=285.6 kJ·mol 1,
因此,本题正确答案为:285.6 kJ·mol 1;
(2)设O2物质的量为x ,O3物质的量为y,那么 x + y =![]() ①
①
混合气体中共含O质量为21.6g-20g=1.6g,所以 16g/mol(2x+3y)=1.6g![]() ②
②
联立①、②方程解得: x=0.02mol,y=0.02mol,
所以 O3的体积分数为![]() ×100% = 50%,
×100% = 50%,
因此,本题正确答案为:50%;
(3)①I2(aq)+I(aq) ![]() I3-(aq),平衡常数K=
I3-(aq),平衡常数K=![]() =680,当c(I3-)/c(I-)=6.8时,
=680,当c(I3-)/c(I-)=6.8时,
c(I2)=![]() =0.01mol/L,
=0.01mol/L,
②从图2数据可知,第二组(有Fe2+)生成的I3-的浓度明显比第一组(没有Fe2+)大,说明使用Fe2+能够使平衡I2 (aq)+I (aq)![]() I3 (aq)向正反应方向移动,I的转化率增大,
I3 (aq)向正反应方向移动,I的转化率增大,
③从图2数据可知,第二组实验18 s后,I3—浓度下降。导致I3—浓度下降的原因是c(I )减小,I2 (aq)+I (aq)![]() I3 (aq) 平衡向逆反应方向移动,
I3 (aq) 平衡向逆反应方向移动,
因此,本题正确答案为:0.01mol/L;增大;c(I )减小,I2 (aq)+I (aq)![]() I3 (aq) 平衡向逆反应方向移动;
I3 (aq) 平衡向逆反应方向移动;
(4)①由图3可知,O3和NO2是反应物,O2和X是生成物,发生的反应为O3+NO2--O2+X,物质的变化量之比等于化学计量数之比,由图可知,n(O3):n(NO2):n(O2):n(X)=2:4:2:2=1:2:1:1,则化学方程式为:O3+2NO2=O2+X,根据质量守恒定律,可确定X中含有2个N原子和5个O原子,化学式为N2O5,
②因为电解质溶液为稀硫酸,电解后生成了H2和O3,故在阴极上是H+得电子生成H2,在阳极上是OH-失电子生成O3,因为在酸性溶液中,故阳极上反应物可写为H2O,电极反应式为3H2O6e ==O 3 ↑+6H +,
因此,本题正确答案为:N2O5;3H2O6e ==O 3 ↑+6H +。

 名题金卷系列答案
名题金卷系列答案 优加精卷系列答案
优加精卷系列答案【题目】CO2是一种廉价的碳资源,其综合利用具有重要意义。回答下列问题。
(1)CO2可以被NaOH溶液捕获。若所得溶液pH=13,CO2主要转化为_______(写离子符号);若所得溶液c(HCO3-):c(CO32-)=2:1,溶液pH=______。(室温下,H2CO3的K1=4×10-7;K2=5×10-11)
(2)CO2与CH4经催化重整,制得合成气:CH4(g)+CO2(g) ![]() (2CO(g)+2H2(g)
(2CO(g)+2H2(g)
①已知上述反应中相关的化学键键能数据如下:
化学键 | C—H | C=O | H—H | C |
键能/kJ·mol-1 | 413 | 745 | 436 | 1075 |
则该反应的△H=___________。分别在VL恒温密闭容器A(恒容)、B(恒压,容积可变)中,加入CH4和CO2各1mol的混合气体。两容器中反应达平衡后放出或吸收的热量较多的是____________(填“A”或“B”)
②按一定体积比加入CH4和CO2,在恒压下发生反应,温度对CO和H2产率的影响如下图所示。此反应优选温度为900℃的原因是_______________。
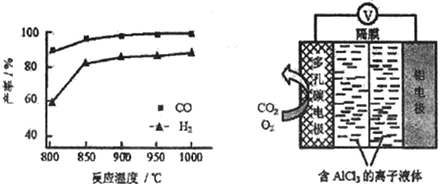
(3)O2辅助的A1-CO2电池工作原理如上图所示。该电池电容量大,能有效利用CO2,电池反应产物Al2(C2O4)3是重要的化工原料。
电池的正极反应式:6O2+6e-=6O2- 6CO2+6O2-=3C2O42-+6O2
反应过程中O2的作用是_______________。该电池的总反应式:_________________。