��Ŀ����
��25�棬���ܵ���ʵ��ܶȻ�������Ksp[CaF2]��1.5��10-10��Ksp[Mg(OH)2]=1.8��10-11��Ksp [Cu(OH)2]=2.2��10-20
�����������ˮ��Һ�д��ڵ��볣��������һԪ����HAH++A-������볣������ʽ Ka= c��H+����c (A-)/ c (HA)����Ũ��Ϊƽ��ʱŨ�ȣ����ó�����Ũ�ȡ�ѹǿ�أ�ֻ���¶ȵĺ�����25�棬�����Ka=1.76��10-5
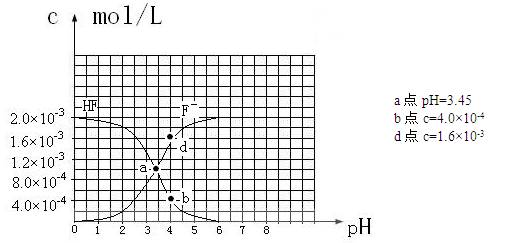
��25��ʱ��2.0��10-3mol��L-1�����ˮ��Һ�У�������ҺpH����������仯�����õ�
c��HF����c��F-������ҺpH�ı仯��ϵ������ͼ��ʾ��
�����������Ϣ�ش��������⣺
��1��25��ʱ����Ũ�Ⱦ�Ϊ0.1mol��L-1��MgCl2��CuCl2�����Һ����μ��백ˮ��������__________�������ѧʽ�������ɸó��������ӷ���ʽΪ ��
��2��25��ʱ��HF���볣������ֵKa![]() ����ʽ��˵���ó��ó��������� ��
����ʽ��˵���ó��ó��������� ��
��3��25��ʱ����Ũ�Ⱦ�Ϊ0.1mol��L-1����ͬ�����HF�ʹ���������Һ�зֱ������ͬ������п������ʼʱ�������������ʹ�ϵΪ ���������������������ͬ������Ӧ�����������������ʵ����Ĺ�ϵΪ ������Һ��c (F-) c (CH3COO-)��
��4��25��ʱ��4.0��10-3mol��L-1HF��Һ��4.0��10-4 mol��L-1 CaCl2��Һ�������ϣ����ڻ��ҺpHΪ4.0�����Ե��ڻ��Һ����ı仯����ͨ����ʽ����˵���Ƿ��г���������
��1��Cu(OH)2��2�֣��� Cu2++2NH3��H2O=Cu(OH)2 ��+2NH4+��2�֣�
��2��Ka=0.4��10-3��10-3.45����3�֣�
HF����ƽ�ⳣ��Ka= ��c��H+��c��F-����/ c��HF��������c��H+����c��F-����c��HF�����ǵ���ﵽƽ��ʱ��Ũ�ȣ�ѡ���м��ͼ����⡣����ͼ��PH=4ʱ��c��H+��=10-4��c��F-��=1.6��10-3��c��HF��=4.0��10-4�� Ka=0.4��10-3���������a������c��H+��=10-3.45 ��c��F-��=c��HF����Ka= 10-3.45����2�֣�
��3�������� ������3�֣�
��4��PH=4.0����c��H+��=10-4����ʱ������HF���������c��F-��=1.6��10-3������Һ�е�c��Ca2+��=2.0��10-4��c 2��F-����c��Ca2+��=5.12��10-10��5.12��10-10����Ksp��CaF2����![]() ����ʱ������������������3�֣�
����ʱ������������������3�֣�
����:��

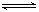 H++A-������볣������ʽ Ka= c��H+����c (A-)/ c (HA)����Ũ��Ϊƽ��ʱŨ�ȣ����ó�����Ũ�ȡ�ѹǿ�أ�ֻ���¶ȵĺ�����25�棬�����Ka=1.76��10-5
H++A-������볣������ʽ Ka= c��H+����c (A-)/ c (HA)����Ũ��Ϊƽ��ʱŨ�ȣ����ó�����Ũ�ȡ�ѹǿ�أ�ֻ���¶ȵĺ�����25�棬�����Ka=1.76��10-5
 ����ʽ��˵���ó��ó��������� ��
����ʽ��˵���ó��ó��������� �� H++A-������볣������ʽ Ka= c��H+����c (A-)/ c (HA)����Ũ��Ϊƽ��ʱŨ�ȣ����ó�����Ũ�ȡ�ѹǿ�أ�ֻ���¶ȵĺ�����25�棬�����Ka=1.76��10-5
H++A-������볣������ʽ Ka= c��H+����c (A-)/ c (HA)����Ũ��Ϊƽ��ʱŨ�ȣ����ó�����Ũ�ȡ�ѹǿ�أ�ֻ���¶ȵĺ�����25�棬�����Ka=1.76��10-5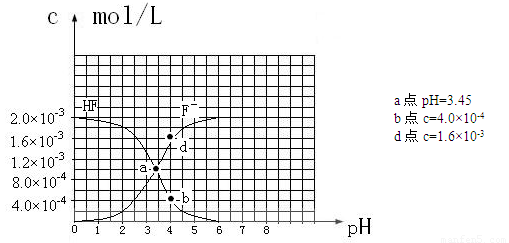
 ����ʽ��˵���ó��ó��������� ��
����ʽ��˵���ó��ó��������� ��