题目内容
①25℃,难溶电解质的溶度积常数:Ksp[CaF2]=1.5×10-10,Ksp[Mg(OH)2]=1.8×10-11,Ksp [Cu(OH)2]=2.2×10-20
②弱电解质在水溶液中存在电离常数:例如一元弱酸HA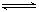 H++A-,其电离常数表达式 Ka= c(H+)·c (A-)/ c (HA)(各浓度为平衡时浓度)。该常数与浓度、压强无关,只是温度的函数。25℃,醋酸的Ka=1.76×10-5
H++A-,其电离常数表达式 Ka= c(H+)·c (A-)/ c (HA)(各浓度为平衡时浓度)。该常数与浓度、压强无关,只是温度的函数。25℃,醋酸的Ka=1.76×10-5
③25℃时,2.0×10-3mol·L-1氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到
c(HF)、c(F-)与溶液pH的变化关系,如下图所示:
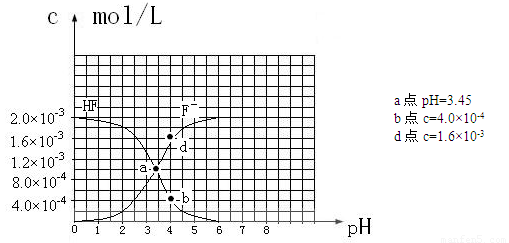
请根据以上信息回答下列问题:
(1)25℃时,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为 。
(2)25℃时,HF电离常数的数值Ka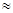 ,列式并说明得出该常数的理由 。
,列式并说明得出该常数的理由 。
(3)25℃时,向浓度均为0.1 mol·L-1的相同体积的HF和醋酸两种溶液中分别加入相同的足量锌粒,初始时产生氢气的速率关系为 (填“>”“=”或“<”,下同)。反应结束后,产生氢气的物质的量的关系为 ,两溶液中c (F-) c (CH3COO-)。
(4)25℃时,4.0×10-3mol·L-1HF溶液与4.0×10-4 mol·L-1 CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化),通过列式计算说明是否有沉淀产生。
(1)Cu(OH)2(2分), Cu2++2NH3·H2O=Cu(OH)2 ↓+2NH4+(2分)
(2)Ka=0.4×10-3或10-3.45。(3分)
HF电离平衡常数Ka= 【c(H+)c(F-)】/ c(HF),其中c(H+)、c(F-)、c(HF)都是电离达到平衡时的浓度,选择中间段图像求解。根据图像:PH=4时,c(H+)=10-4,c(F-)=1.6×10-3、c(HF)=4.0×10-4, Ka=0.4×10-3。(或根据a点数据c(H+)=10-3.45 、c(F-)=c(HF)得Ka= 10-3.45)(2分)
(3)>,= ,>(3分)
(4)PH=4.0,则c(H+)=10-4,此时:根据HF电离产生的c(F-)=1.6×10-3,而溶液中的c(Ca2+)=2.0×10-4。c 2(F-)×c(Ca2+)=5.12×10-10,5.12×10-10大于Ksp(CaF2)= ,此时有少量沉淀产生。(3分)
,此时有少量沉淀产生。(3分)
【解析】略

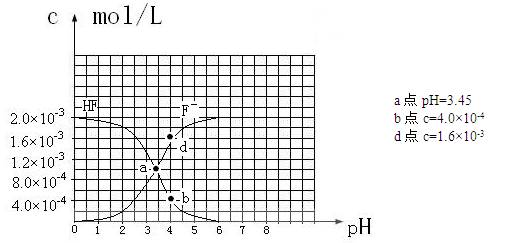
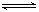 H++A-,其电离常数表达式 Ka= c(H+)·c (A-)/ c (HA)(各浓度为平衡时浓度)。该常数与浓度、压强无关,只是温度的函数。25℃,醋酸的Ka=1.76×10-5
H++A-,其电离常数表达式 Ka= c(H+)·c (A-)/ c (HA)(各浓度为平衡时浓度)。该常数与浓度、压强无关,只是温度的函数。25℃,醋酸的Ka=1.76×10-5
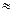 ,列式并说明得出该常数的理由 。
,列式并说明得出该常数的理由 。