题目内容
【题目】根据题意填空
(1)下列实验操作或对实验事实的描述不正确的是(填序号).
A.不宜用瓷坩埚灼烧氢氧化钠或碳酸钠
B.使用容量瓶配制溶液时,俯视刻度线定容后所得溶液浓度偏大
C.分液操作时,由于分液漏斗下端已沾满下层液体,故上层液体要从上口倒出
D.用托盘天平称量11.74g氯化钠晶体
E.用结晶法分离硝酸钾和氯化钠的混合物
(2)实验室需要0.1molL﹣1NaOH溶液450mL和0.5molL﹣1硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题:
①如图1所示的仪器中配制溶液肯定不需要的是(填序号);配制上述溶液还需用到的玻璃仪器是(填仪器名称).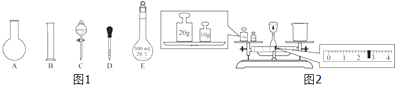
②下列操作中,容量瓶所不具备的功能有(填序号).
A.配制一定体积准确浓度的标准溶液
B.贮存溶液
C.测量容量瓶规格以下的任意体积的液体
D.准确稀释某一浓度的溶液
E.用来加热溶解固体溶质
③请计算需用托盘天平称取固体NaOH的质量为g.某同学用托盘天平称量烧杯的质量,天平平衡后的状态如图2.由图中可以看出,烧杯的实际质量为g.
④根据计算得知,所需质量分数为98%、密度为1.84gcm﹣3的浓硫酸的体积为mL(计算结果保留一位小数).配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是 .
【答案】
(1)D
(2)AC;玻璃棒、烧杯;BCDE;2.0;27.4;13.6;浓硫酸稀释放出大量的热,将浓硫酸沿器壁(或玻璃棒)慢慢注入水中,且边加边搅拌
【解析】解:(1)A.瓷坩埚中二氧化硅与NaOH、碳酸钠等反应,则不能用瓷坩埚灼烧氢氧化钠或碳酸钠,故A正确;B.俯视刻度线定容后,水加少了,则溶液体积偏小,由c= ![]() 可知,浓度偏大,故B正确;
可知,浓度偏大,故B正确;
C.分液时避免上下液体混合,则分液时下层液体从下口流出,上层液体从上口倒出,故C正确;
D.托盘天平的感量为0.1g,则用托盘天平称量11.7g氯化钠晶体或用托盘天平称量11.8g氯化钠晶体,故D错误;
E.硝酸钾和氯化钠的溶解度受温度影响不同,可选结晶法分离,故E正确;
故选D.(2)①配制一定物质的量浓度溶液的步骤有:计算、称量(量取)、溶解(稀释)、移液、洗涤、定容、摇匀、装瓶等,用的仪器有:托盘天平(量筒)、药匙、烧杯、筒量、玻璃棒、容量瓶、胶头滴管,不需要的仪器有烧杯和分液漏斗,要配置450mL溶液应选择500mL容量瓶,所有用不到的仪器:AC;还需要的仪器:玻璃棒和烧杯;
所以答案是:AC;玻璃棒、烧杯;②容量瓶只能用来配制一定体积准确浓度的溶液,不能配制或测量容量瓶规格以下的任意体积的液体,不能稀释或溶解药品,不能用来加热溶解固体溶质,
所以答案是:BCDE;③要配置450mL0.1molL﹣1NaOH溶液应选择500mL容量瓶,需要氢氧化钠的质量=0.1mol/L×0.5L×40g/mol=2.0g;
托盘天平使用应遵循左物右码的原则,物码放反,则砝码的质量等于物的质量+游码的质量,则质量=砝码的质量﹣游码的质量,所以实际质量=30g﹣2.6g=27.4g,
所以答案是:2.0;27.4;④质量分数为98%、密度为1.84g/cm3的浓硫酸的物质的量浓度为= ![]() =18.4mol/L,配0.5molL﹣1硫酸溶液500mL,浓硫酸稀释前后溶质的物质的量不变,设浓硫酸的体积为V,所以18.4mol/L×V=0.5/L×0.5L,得V=0.0136L=13.6mL,浓硫酸稀释放出大量的热,将浓硫酸沿器壁(或玻璃棒)慢慢注入水中,且边加边搅拌;
=18.4mol/L,配0.5molL﹣1硫酸溶液500mL,浓硫酸稀释前后溶质的物质的量不变,设浓硫酸的体积为V,所以18.4mol/L×V=0.5/L×0.5L,得V=0.0136L=13.6mL,浓硫酸稀释放出大量的热,将浓硫酸沿器壁(或玻璃棒)慢慢注入水中,且边加边搅拌;
所以答案是:13.6;浓硫酸稀释放出大量的热,将浓硫酸沿器壁(或玻璃棒)慢慢注入水中,且边加边搅拌.
【考点精析】根据题目的已知条件,利用配制一定物质的量浓度的溶液的相关知识可以得到问题的答案,需要掌握配制物质的量浓度溶液时,先用烧杯加蒸馏水至容量瓶刻度线1cm~2cm后,再改用交投滴管加水至刻度线.




