题目内容
(12分)某研究性小组用0.20 mol/L NaOH溶液滴定未知浓度的白醋(指示剂为酚酞)。
请回答:
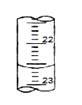
(1)下图表示50 ml滴定管中液面的位置,若A与C刻度间相差1ml,A处的刻度为20,此时滴定管中液体的体积 mL。
(2)滴定过程中,眼睛始终注视 ,直到锥形瓶中液体的颜色……。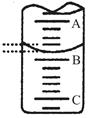
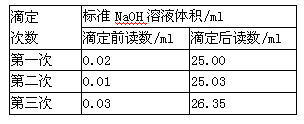
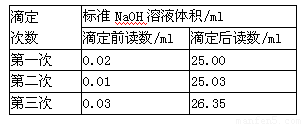
(3)同学们进行了三次实验,每次取白醋 20.00 ml, 实验结果记录如上表:请计算白醋的物质的量浓度为_________ (保留两位有效数字)。
(4)操作时用白醋润洗锥形瓶,对滴定结果产生的影响是________(填“偏大”或“偏小”或“无影响”。下同)。若用白醋润洗酸式滴定管,对滴定结果产生的影响是 。
(5)若滴定终点时测得pH=7。下列离子浓度的比较正确的是 。
| A.c(Na+)>c(CH3COO—) | B.c(Na+)<c(CH3COO—) |
| C.c(Na+)=c(CH3COO—) | D.不能确定 |
(12分)(1)>29.60Ml (2)锥形瓶中液体颜色的变化
(3)0.25 mol/L (4)偏大 无影响 (5)C
解析试题分析:(1)滴定管的刻度自上而下是逐渐增大的,且能准确读数到0.1ml,所以根据图中刻度线的位置可知,此时滴定管中液体的体积大于50.00ml-20.40ml=29.60ml。
(2)滴定过程中,眼睛始终注视锥形瓶中液体颜色的变化,直到锥形瓶中液体的颜色发生变化。
(3)根据表中数据可知,三次实验中消耗氢氧化钠溶液的体积分别是24.98ml、25.02mol、26.32ml,显然第三次的实验误差太大,舍去,则实际消耗氢氧化钠溶液体积的平均值是(24.98ml+25.02mol)÷2=25.00ml,所以白醋的物质的量浓度是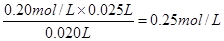 。
。
(4)操作时用白醋润洗锥形瓶,则消耗氢氧化钠溶液的体积增加,则滴定结果偏大。若用白醋润洗酸式滴定管,则测定结果不影响。
(5)根据电荷守恒可知c(Na+)+c(H+)=c(OH—)+c(CH3COO—),由于溶液显中性,则c(H+)=c(OH—),所以c(Na+)=c(CH3COO—),答案选C。
考点:考查滴定管的构造、读数,中和滴定的操作和计算以及误差分析,溶液中离子浓度大小比较
点评:该题是中等难度的试题,试题基础性强,难易适中,贴近高考。该题在注重对学生基础性知识巩固与训练的同时,侧重对学生能力的培养和解题方法的指导与训练,有助于培养学生的逻辑推理能力和灵活应变能力。该题的难点在于误差分析和离子浓度大小比较。

 53随堂测系列答案
53随堂测系列答案