��Ŀ����
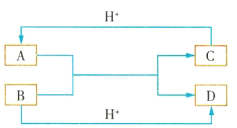
����Ŀ������2CrO42��+2H+ ![]() Cr2O72��+H2O�����ͼ��װ�ã���Ϊ���Ե缫�����Na2CrO4��Һ��ȡNa2Cr2O7��ͼ�����Ҳ�缫���ӵ�Դ��_________��������Ʊ����̵��ܷ�Ӧ����ʽΪ_________���ⶨ����Һ��Na��Cr�ĺ�������Na��Cr�����ʵ���֮��Ϊa��b�����ʱNa2CrO4��ת����Ϊ_________����ѡ��������K2CO3�����ʵļ״���CH3OH��ȼ�ϵ�س䵱��Դ������ӦʽΪ________________��
Cr2O72��+H2O�����ͼ��װ�ã���Ϊ���Ե缫�����Na2CrO4��Һ��ȡNa2Cr2O7��ͼ�����Ҳ�缫���ӵ�Դ��_________��������Ʊ����̵��ܷ�Ӧ����ʽΪ_________���ⶨ����Һ��Na��Cr�ĺ�������Na��Cr�����ʵ���֮��Ϊa��b�����ʱNa2CrO4��ת����Ϊ_________����ѡ��������K2CO3�����ʵļ״���CH3OH��ȼ�ϵ�س䵱��Դ������ӦʽΪ________________��
���𰸡��� 4Na2CrO4+4H2O![]() 2Na2Cr2O7+4NaOH+2H2��+O2�� ��2��
2Na2Cr2O7+4NaOH+2H2��+O2�� ��2��![]() ����100% CH3OH��6e��+3CO32��=4CO2+2H2O
����100% CH3OH��6e��+3CO32��=4CO2+2H2O
��������
�Ҳ�缫����H����������OH��������������Ӧ���Ҳ�Ϊ�����������Ϊ���������ӵ�Դ�ĸ��������ݷ�Ӧ����ʽ���㣻�״���CH3OH���ڸ�������������Ӧ��
����2CrO42��+2H��=Cr2O72��+H2O�����Na2CrO4��Һ��ȡNa2Cr2O7��Ӧ�����������½��У����Ҳ�缫����H����������OH��������������Ӧ���Ҳ�Ϊ�����������Ϊ���������ӵ�Դ�ĸ���������Ʊ����̵��ܷ�Ӧ����ʽΪ 4Na2CrO4+4H2O ![]() 2Na2Cr2O7+4NaOH+2H2��+O2��������뷴Ӧ�����ڵ�Na2CrO4Ϊ1mol����Ӧ��������xmol Na2CrO4ת��ΪNa2Cr2O7����������ʣ��Na2CrO4Ϊ��1-x��mol����Ӧ��n��Na��=2��1-x��mol��n��Cr��=��1-x��mol�����ɵ�Na2Cr2O7Ϊ
2Na2Cr2O7+4NaOH+2H2��+O2��������뷴Ӧ�����ڵ�Na2CrO4Ϊ1mol����Ӧ��������xmol Na2CrO4ת��ΪNa2Cr2O7����������ʣ��Na2CrO4Ϊ��1-x��mol����Ӧ��n��Na��=2��1-x��mol��n��Cr��=��1-x��mol�����ɵ�Na2Cr2O7Ϊ![]() mol����Ӧ��n��Na��=xmol��n��Cr��=xmol�����ݣ�Na��Cr�����ʵ���֮��Ϊa:b�����x=2-
mol����Ӧ��n��Na��=xmol��n��Cr��=xmol�����ݣ�Na��Cr�����ʵ���֮��Ϊa:b�����x=2-![]() ��ת����Ϊ
��ת����Ϊ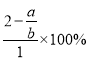 =��2-
=��2-![]() ����100%����ѡ��������K2CO3�����ʵļ״���CH3OH��ȼ�ϵ�س䵱��Դ������ӦʽΪCH3OH-6e��+3CO32��=4CO2+2H2O���ʴ�Ϊ������ 4Na2CrO4+4H2O
����100%����ѡ��������K2CO3�����ʵļ״���CH3OH��ȼ�ϵ�س䵱��Դ������ӦʽΪCH3OH-6e��+3CO32��=4CO2+2H2O���ʴ�Ϊ������ 4Na2CrO4+4H2O ![]() 2Na2Cr2O7+4NaOH+2H2��+O2������2-
2Na2Cr2O7+4NaOH+2H2��+O2������2-![]() ����100%��CH3OH-6e��+3CO32��=4CO2+2H2O��
����100%��CH3OH-6e��+3CO32��=4CO2+2H2O��