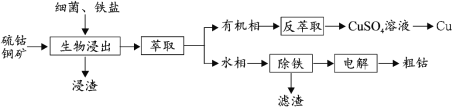
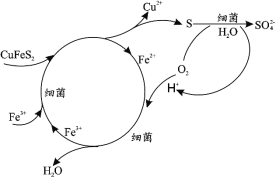
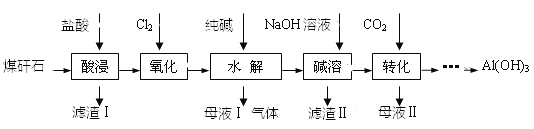
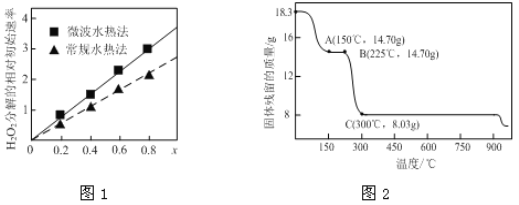
��Ŀ����
����Ŀ����һþ���Ͻ�51 g��������뵽1 L 5 mol��L��1�������У�ǡ�÷�Ӧ�ꡣ
(1)���ںϽ������˵����ȷ����________��
A���Ͻ�ֻ�������ֻ��������ϵĽ������
B���Ͻ��Ӳ��һ�������ɳɷֽ�����Ӳ�ȴ�
C��þ���۳ɺϽ�Ĺ�����һ����ѧ����
D���Ͻ���۵�һ�������ɳɷֵ��۵��
E���Ͻ�߱�����������
(2) �úϽ���þ���������ֱ�Ϊ________g��________g��
(3) ��Ӧ�й��ռ�������µ����������Ϊ___________L��
(4)��Ӧ�����Һ����μ���5 mol��L��1��NaOH��Һ����Ҫʹ����ǡ�ôﵽ���ֵ����Ҫ����NaOH________L��
���𰸡�BDE 24g 27g 56 1
��������
(1) �Ͻ��������ֻ��������ϵĽ���(�������ǽ���)�ں���һ���γɵľ��н������Ե����ʣ��Ͻ��Ӳ��һ��ȳɷֽ������۵�һ��ȳɷֽ����͡�
(2) þ���Ͻ�51 g��������뵽1 L 5 mol��L��1�������У�ǡ�÷�Ӧ�꣬��Ӧ��������ҺΪMgCl2��AlCl3�Ļ��Һ����Ͻ���þ�����ʵ���Ϊamol���������ʵ���Ϊbmol����24a+27b=51�����ⷴӦ��MgCl2��AlCl3�Ļ��ҺΪ�����ԣ���2a+3b=5��
(3)���ݵ����غ㼴�ɽ�÷�Ӧ���������������ʵ�����
(4) ��Ӧ�����Һ����μ���5 mol��L��1��NaOH��Һ��������ǡ�ôﵽ���ֵʱ��������ҺΪNaCl���ɵ���غ��֪n(Cl-)=n(Na+)��
(1) A���Ͻ��������ֻ��������ϵĽ���(�������ǽ���)�ں���һ���γɵľ��н������Ե����ʣ���A����
B���Ͻ��Ӳ��һ��ȳɷֽ�����B��ȷ��
C��þ���۳ɺϽ�Ĺ�����һ���������̣���C����
D���Ͻ���۵�һ��ȳɷֽ����ͣ�����D��ȷ��
E���Ͻ��Ǿ��н������Ե����ʣ���E��ȷ��
�ʴ�ΪBDE��
(2) þ���Ͻ�51 g��������뵽1 L 5 mol��L��1�������У�ǡ�÷�Ӧ�꣬��Ӧ��������ҺΪMgCl2��AlCl3�Ļ��Һ����Ͻ���þ�����ʵ���Ϊamol���������ʵ���Ϊbmol����24a+27b=51�����ⷴӦ��MgCl2��AlCl3�Ļ��ҺΪ�����ԣ���2a+3b=5���ⷽ����24a+27b=51��2a+3b=5�ã�a=b=1����þ���Ͻ���Mg������Ϊ1mol��24g/mol=24g��Al������Ϊ1mol��27g/mol=27g��
(3) �跴Ӧ���������������ʵ���Ϊnmol�����ݵ����غ�ɵ�1mol��2+1mol��3=nmol��2����ã�n=2.5�������������ڱ���µ����Ϊ2.5mol��22.4L/mol=56L��
(4) ��Ӧ�����Һ����μ���5 mol��L��1��NaOH��Һ��������ǡ�ôﵽ���ֵʱ��������ҺΪNaCl���ɵ���غ��֪n(Cl-)=n(Na+)=1L��5 mol��L��1=5mol��������NaOH��Һ��NaOH�����ʵ���Ϊ5mol����Һ���Ϊ![]() =1L��
=1L��

 ���ѵ����Ԫ��ĩ���100��ϵ�д�
���ѵ����Ԫ��ĩ���100��ϵ�д� ��˼άС�ھ�100����ҵ��ϵ�д�
��˼άС�ھ�100����ҵ��ϵ�д� ��ʦָ��һ��ͨϵ�д�
��ʦָ��һ��ͨϵ�д�����Ŀ����������Ϊһ�����ʹ��ܵ�أ���Ӧ���õ����Ӻͷ�չ��
��1�������������ڽ����ơ�������Ͷ����ƣ�Na2SX���ֱ���Ϊ�����缫�ķ�Ӧ�����Al2O3�մɣ��ɴ���Na+��Ϊ����ʣ��䷴Ӧԭ������ͼ��ʾ��
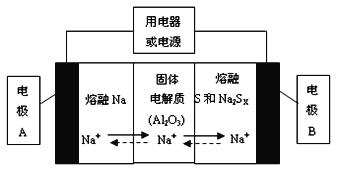
�ٸ������ұ����ݣ������жϸõ�ع���������Ӧ������_________������ĸ����Χ�ڡ�
���� | Na | S | Al2O3 |
�۵�/�� | 97.8 | 115 | 2050 |
�е�/�� | 892 | 444.6 | 2980 |
a��100������ b��100��300�� c��300��350�� d��350��2050��
�ڷŵ�ʱ���缫AΪ_________�����缫B����_________��Ӧ������������ԭ����
�۳��ʱ���ܷ�ӦΪNa2SX=2Na+xS��3��x��5�����������ĵ缫��ӦʽΪ��________________��
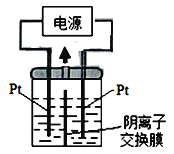
��2��������������Ϊ��Դ��������װ��KI��������Һ��ͼ��ʾ�����ڵ��м��������ӽ���Ĥ������ͨ��һ��ʱ����������Һ����ɫ��һ��ʱ�����ɫ��dz�����Ҳ���ĵ缫����ʽ��___________���Է��������Һ��ɫ��dz�Ŀ���ԭ���ǣ�___________��
��3��������������Ϊ��Դ������ͼ��ʾװ�ý���ʵ�����ҳغͱ��أ�
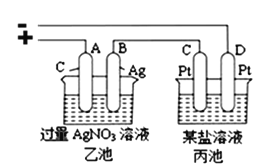
��������������0.05xmol��Sʱ���������ҳ���B������������__________g����ʱ��װ����___________������C������D�����缫����7.20g���������װ���е�ij����Һ������_______������ţ���
a.MgSO4��Һ b.CuSO4��Һ c.NaCl��Һ d.AgNO3��Һ