题目内容
二元弱酸是分步电离的,25时碳酸和草酸的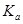 如下表:
如下表:
| H2CO3 | Ka1=4.3×10-7 | H2C2O4 | Ka1=5.6×10-2 |
| Ka2=5.6×10-11 | Ka2=5.42×10-5 |
(1)设有下列四种溶液:
A.0.1 mol/L的Na2C2O4溶液 B.0.1 mol/L的NaHC2O4溶液
C.0.1 mol/L的Na2CO3溶液 D.0.1 mol/L的NaHCO3溶液
其中,c(H+)最大的是_________,c(OH-)最大的是_________ 。
(2)某化学实验兴趣小组同学向用大理石和稀盐酸制备CO2后残留液中滴加碳酸钠溶液,在溶液中插人pH传感器,测得pH变化曲线如图所示。
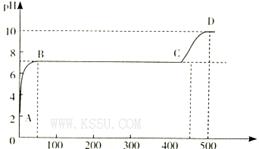
刚开始滴人碳酸钠溶液时发生反应的离子方程式为_________,BC段发生反应的离子方程式为_____,D点时混合溶液中由水电离产生的c(H+)="_________" mol/L。
(1)B C (2)2H++CO32-=H2O+CO2↑ Ca2++CO32-=CaCO3↓ 10-4
解析试题分析:(1)因为H2C2O4的二级电离平衡常数Ka2=5.42×10-5> H2CO3的二级电离平衡常数Ka2=5.6×10-11。所以在这四种溶液c(H+)最大的是0.1 mol/L的NaHC2O4溶液。正确选项为B.电离平衡常数越小,其钠盐水解的程度就越大。溶液的碱性就越强。由于Ka2(H2C2O4)=5.42×10-5> 5.6×10-11= Ka2(H2CO3),所以c(OH-)最大的是0.1 mol/L的Na2CO3溶液。正确选项为C.(2)在反应开始时由于溶液的pH略大于2,说明溶液中含有过量稀盐酸电离产生大量的H+。此时滴入碳酸钠溶液时发生反应的离子方程式为2H++CO32-=H2O+CO2↑;在PH=7,溶液呈中性时发生的反应为CaCl2+Na2CO3="2NaCl+" CaCO3↓.反应的离子方程式为Ca2++CO32-=CaCO3↓。当该反应发生完全后继续加入Na2CO3,则是Na2CO3和NaCl的混合溶液。NaCl是强酸强碱盐,不发生水解反应,而Na2CO3是强碱弱酸盐,弱酸根离子发生水解反应,消耗水电离产生的H+,使溶液显碱性。在D点溶液的pH=10,则c(H+)=10-10mol/L.由于H+you 消耗,所以水电离产生的OH-的浓度为:c(OH-)=Kw÷c(H+)=10-4mol/L.所以c(H+)(水)= c(OH-)(水)= 10-4mol/L。
考点:考查盐的水解、电离平衡常数及图像法的应用。主要包括盐溶液中的c(H+)、c(OH-)\的比较及混合溶液中离子方程式的书写及盐水解时水电离产生的离子浓度的问题。

 阅读快车系列答案
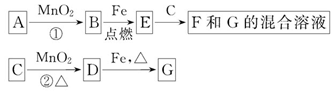
阅读快车系列答案铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式 。
| |
正极反应 负极反应 。
(3)腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为
0.10mol·L-1,请参照下表给出的数据和药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤 。
| | 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH |
| Fe3+ Fe2+ Cu2+ | 1.9 7.0 4.7 | 3.2 9.0 6.7 |
| 提供的药品:Cl2 浓H2SO4 NaOH溶液 CuO Cu | ||
(4)某科研人员发现劣质不锈钢在酸中腐蚀缓慢,但在某些盐溶液中腐蚀现象明显。请从上表提供的药品中选择两种(水可任选),设计最佳实验,验证劣质不锈钢易被腐蚀。
有关反应的化学方程式
劣质不锈钢腐蚀的实验现象
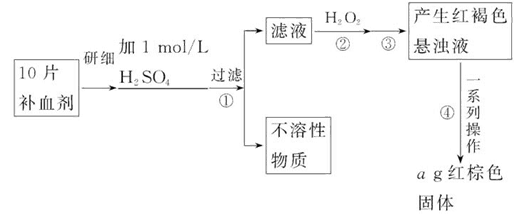
上利用硫铁矿烧渣(主要成分为Fe2O3、FeO、SiO2等)为原料制备高档颜料铁红(Fe2O3),具体生产流程如下:
试回答下列问题:
(1)滤液X中含有的金属阳离子是______________(填离子符号)。
(2)步骤Ⅲ中可选用________调节溶液的pH(填字母)。
| A.稀硫酸 | B.氨水 | C.氢氧化钠溶液 | D.高锰酸钾溶液 |
(4)步骤Ⅳ的反应温度一般需控制在35℃以下,其目的是_____________________________________________。
(5)在空气中煅烧FeCO3生成产品氧化铁的化学方程式为______________________________。
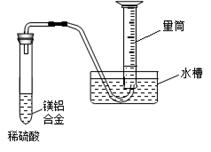
如图是测定铝粉(含镁粉)的纯度的实验装置。所用的NaOH(足量)的物质的量浓度为4.5 mol·L-1。不同时间电子天平的读数如下表所示:
| 实验操作 | 时间/min | 电子天平的读数/g |
| 烧杯+NaOH溶液 | 0 | 120 |
| 烧杯+NaOH溶液+样品 | 0 | 135 |
| 1 | 134.5 | |
| 2 | 134.1 | |
| 3 | 133.8 | |
| 4 | 133.8 |
(1)反应中生成气体的质量 g。
(2)试计算样品中铝的质量分数。(写出解题过程)
(3)反应后溶液(溶液的体积变化忽略)的c(OH-)。(写出解题过程)
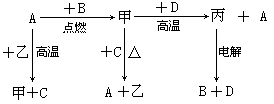
(10分)工业上综合利用黄铜矿(CuFeS2)制备净水剂高铁酸钠(Na2FeO4)、铜及其化合物的工业流程如下图所示:
(1)冶炼铜的反应为8CuFeS2+21O2 8Cu+4FeO+2Fe2O3+16SO2。若中CuFeS2铁元素的化合价为+2,1molCuFeS2参与反应转移电子的物质的量为_______ mol。
8Cu+4FeO+2Fe2O3+16SO2。若中CuFeS2铁元素的化合价为+2,1molCuFeS2参与反应转移电子的物质的量为_______ mol。
(2)利用炉渣(含Fe2O3、FeO、SiO2、Al2O3)制备高铁酸钠的方法为:
①用稀盐酸浸取炉渣,过滤;
②向滤液中加入足量H2O2溶液,再加入足量NaOH溶液,过滤,将沉淀洗涤、于燥得Fe(0H)3;
③Fe(OH)3与NaClO和NaOH反应,生成高铁酸钠。
a.写出制取高铁酸钠的化学方程式:______________________;
b.验证炉渣中含有FeO必要的化学试剂为________________________。
(3)制备纳米氧化亚铜(Cu2O)时用铜棒和石墨做电极,饱和食盐水做电解质,电解反应为2Cu+H2O Cu2O+H2↑。铜棒上发生的电极反应式为_________________________________________。(5)直接排放含SO2的烟气会形成酸雨,危害环境。用NaOH溶液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
Cu2O+H2↑。铜棒上发生的电极反应式为_________________________________________。(5)直接排放含SO2的烟气会形成酸雨,危害环境。用NaOH溶液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 1:91 |
| pH(25℃) | 8.2 | 7.2 | 6.2 |