题目内容
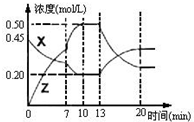 向一容积为1L的密闭容器中加入一定量的X、Y,发生化学反应
向一容积为1L的密闭容器中加入一定量的X、Y,发生化学反应X(g)+2Y(s)?2Z(g)△H<0.如图是容器中X、Z的物质的量浓度随时间变化的曲线.
(1)0~10min 容器内气体的压强逐渐
(2)推测在第7min时曲线变化的原因可能是
①增加Z的量 ②增加X的量 ③升温 ④降温 ⑤使用催化剂
(3)推测在第21min时增加Y的用量,平衡
(4)该反应的化学平衡常数表达式为K=
考点:物质的量或浓度随时间的变化曲线
专题:化学平衡专题
分析:(1)根据反应前后气体的化学计量数之和进行判断;
(2)升高温度或使用催化剂可以加快化学反应速率;升高温度,平衡向吸热的方向移动;
(3)根据增加反应物浓度和压强对化学平衡的影响,可以判断;
(4)平衡常数等于生成物浓度系数次幂之积与反应物浓度系数次幂之积的比值,结合化学方程式可以求得K值;
(2)升高温度或使用催化剂可以加快化学反应速率;升高温度,平衡向吸热的方向移动;
(3)根据增加反应物浓度和压强对化学平衡的影响,可以判断;
(4)平衡常数等于生成物浓度系数次幂之积与反应物浓度系数次幂之积的比值,结合化学方程式可以求得K值;
解答:
(1)反应前气体的化学计量数之和为3,反应后气体的化学计量数之和为2,故0~10min 容器内气体的压强逐渐变大,故答案为:变大;
(2)第7min时,单位时间内X、Z的物质的量变化量较大,反应速率明显增大,可能为升高温度或者使用催化剂;第13min时,Z的物质的量减小,X的物质的量增大,说明平衡向逆反应方向移动,该反应为放热反应,应为升高温度,故答案为:③⑤;③;
(3)因为Y是固体,改变Y的量不会影响化学平衡的移动,由于该反应是气体体积增大的反应,增将容器体积由1L变为0.5L时,压强加大,平衡逆向移动;故答案为:不;向逆反应方向;
(4根据反应X(g)+2Y(s) ?2Z(g),Y为固体,所以平衡常数K=
?2Z(g),Y为固体,所以平衡常数K=
,第一次达到平衡时C(X)=0.2mol/L,C(Z)=0.5mol/L,所以K=
=
=1.25,故答案为:
;1.25;
(2)第7min时,单位时间内X、Z的物质的量变化量较大,反应速率明显增大,可能为升高温度或者使用催化剂;第13min时,Z的物质的量减小,X的物质的量增大,说明平衡向逆反应方向移动,该反应为放热反应,应为升高温度,故答案为:③⑤;③;
(3)因为Y是固体,改变Y的量不会影响化学平衡的移动,由于该反应是气体体积增大的反应,增将容器体积由1L变为0.5L时,压强加大,平衡逆向移动;故答案为:不;向逆反应方向;
(4根据反应X(g)+2Y(s)
 ?2Z(g),Y为固体,所以平衡常数K=
?2Z(g),Y为固体,所以平衡常数K=| C2(Z) |
| C(X) |
| C2(Z) |
| C(X) |
| 0.52 |
| 0.2 |
| C2(Z) |
| C(X) |
点评:本题考查化学平衡以及反应速率等问题,题目难度中等,注意图象曲线变化的分析,把握外界条件对反应速率和平衡移动的影响.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
某有机物的分子式是C3H4O2,它的水溶液显酸性,能跟Na2CO3溶液反应,又能使溴水褪色,则该有机物可能发生的反应有( )
①加成反应 ②取代反应 ③酯化反应 ④中和反应 ⑤氧化反应 ⑥加聚反应.
①加成反应 ②取代反应 ③酯化反应 ④中和反应 ⑤氧化反应 ⑥加聚反应.
| A、②③④⑥ | B、③④⑤⑥ |
| C、①②③④⑤⑥ | D、①②④⑤ |
下列混合物能用分液法分离的是( )
| A、酒精与乙酸 |
| B、苯和溴 |
| C、苯和水 |
| D、葡萄糖与蔗糖混合液 |
 已知,CH3CH2OH+NaBr+H2SO4
已知,CH3CH2OH+NaBr+H2SO4