题目内容
【题目】(1)下图所示元素周期表中全部是金属元素的区域为___________
A.A B.B C.C D.D
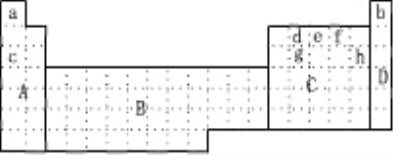
(2)现有甲、乙两种短周期元素,室温下,甲元素单质在冷浓硫酸或空气中,表面都生成致密的氧化膜,乙元素原子核外M电子层与K电子层上的电子数相等。
①用元素符号将甲、乙两元素填写在上面元素周期表中对应的位置。______________
②甲、乙两元素相比较,金属性较强的是_________(填名称),可以验证该结论的实验是_______。
A.将在空气中放置很久的这两种元素的块状单质分别放入热水中
B.将这两元素的单质粉末分别和同浓度的盐酸反应
C.将这两元素的单质粉末分别和热水作用,并滴入酚酞
D.比较这两种元素的气态氢化物的稳定性
(3)上表中所列某些元素间能形成等电子的A、B、C、D、E五种微粒,A与C组成元素相同,B、E、D组成元素相同,它们间能发生如下反应:A+B=C+D,E+B=2D,则写出B的电子式:______,比较C、B、D结合氢离子的能力由强到弱的顺序为_________________(用化学式表示)。
(4)上表中c、h元素形成的简单离子半径之比________ 1(填〉或〈或 =)。
【答案】 B 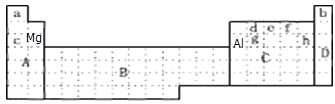 镁 BC
镁 BC ![]() OH->NH3>H2O <
OH->NH3>H2O <
【解析】(1).B区为过渡元素区域,全部为金属元素,A区中H元素为非金属元素,C区中有大量非金属元素;
(2). 甲在冷的浓硫酸或空气中,表面都生成致密的氧化膜的是Al元素,乙为12号元素Mg,①Al元素位于ⅢA主族第三周期,Mg元素位于ⅡA主族第三周期;②Mg元素位于Al元素的左侧,则其金属性强;A. Al的表面会生成一层致密的氧化膜(Al2O3),防止了与水反应,Al2O3不溶于水,故不反应,MgO与水生成Mg(OH)2附着在表面,不与水反应,所以无法检验,A错误;B.根据气泡生成的多少克判断反应速率,进而判断金属性强弱,B正确;C. 依据最高价氧化物的水化物碱性的强弱。碱性越强,其元素的金属性越强,C正确;D.金属没有气态氢化物,D错误。故选择BC;
(3). 可以从常见的10电子微粒来分析判断:HF、OH-、H2O、NH3、H3O+、CH4、NH4+,则两个反应为:NH4++ OH-= NH3+ H2O,OH-+ H3O+=2 H2O,B为OH-,其电子式为: ![]() ;反应NH4++OH-=NH3·H2O,证明结合质子(H+)的能力OH->NH3,反应NH3+H3O+=NH4++H2O证明结合质子(H+)的能力NH3>H2O,可以确定OH-、NH3、H2O结合氢离子的能力为:OH->NH3>H2O;
;反应NH4++OH-=NH3·H2O,证明结合质子(H+)的能力OH->NH3,反应NH3+H3O+=NH4++H2O证明结合质子(H+)的能力NH3>H2O,可以确定OH-、NH3、H2O结合氢离子的能力为:OH->NH3>H2O;
(4). c、h元素分别为:Na和Cl,两者简单离子为Na+、Cl-,Cl-核外电子为3层,其半径大于Na+半径,故c、h简单离子半径之比小与1。

