题目内容
8.已知M、W、X、Y、Z均为短周期元素,M为形成化合物种类最多的元素.W、Z同主族,X、Y、Z同周期,Z元素的原子序数为W的2倍,Z的最外层电子数为Y的最外层电子数的2倍,Y的电子层数和最外层电子数相等,W和X能形成X2W和X2W2两种化合物,下列说法不正确的是( )| A. | W、X、Y形成的简单离子,其半径大小关系为W>X>Y | |
| B. | M、W元素形成的简单氢化物的稳定性:W>M | |
| C. | X是同周期中金属性最强的元素 | |
| D. | Z的最高价氧化物对应的水化物的浓溶液能与Y的单质在常温下剧烈反应 |
分析 M、W、X、Y、Z均为短周期元素,M为形成化合物种类最多的元素,则M为C元素;
W、Z同主族,Z元素的原子序数为W的2倍,则W为O元素,Z为S元素;
X、Y、Z同周期,即处于第三周期,Z的最外层电子数为Y的最外层电子数的2倍,Y的电子层数和最外层电子数相等,则Y为Al元素;
W和X能形成X2W和X2W2两种化合物,X应为Na元素,据此解答.
解答 解:M、W、X、Y、Z均为短周期元素,M为形成化合物种类最多的元素,则M为C元素;W、Z同主族,Z元素的原子序数为W的2倍,则W为O元素,Z为S元素;X、Y、Z同周期,即处于第三周期,Z的最外层电子数为Y的最外层电子数的2倍,Y的电子层数和最外层电子数相等,则Y为Al元素;W和X能形成X2W和X2W2两种化合物,X应为Na元素.
A.W、X、Y对应的简单离子分别为O2-、Na+、Al3+,电子层结构相同的离子,离子半径随着原子序数增大而减小,所以半径大小关系为O2->Na+>Al3+,故A正确;
B.元素的非金属性越强简单氢化物越稳定,非金属性O>C,故氢化物的稳定性H2O>CH4,故B正确;
C.X为Na元素,同周期元素从左到右金属性逐渐减弱,同周期中Na的金属性最强,故C正确;
D.Z的最高价氧化物对应的水化物的浓溶液为浓硫酸,Y是单质为Al,在常温下遇浓硫酸会发生钝化,故D错误,
故选D.
点评 本题考查元素推断及元素周期律,旨在考查考生对物质结构理论的运用能力与推理能力,注意常温下铁和浓硫酸、浓硝酸都发生钝化现象,题目难度不大.

练习册系列答案
相关题目
19.为了避免NO、NO2、N2O4对大气的污染,常采用氢氧化钠溶液进行吸收处理(反应方程式:2NO2+2NaOH=NaNO2+H2O;NO2+NO+2NaOH=2NaNO2+H2O).现有由a mol NO、b molNO2、c molN2O4组成的混合气体恰好被VL氢氧化钠溶液吸收(无气体剩余),则此氢氧化钠溶液的物质的量浓度为( )
| A. | a+b+cVmolgL-1 | B. | a+b+2cVmolgL-1 | C. | 2a+b+cVmolgL-1 | D. | b+2cVmolgL-1 |
13.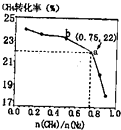 CH4、和N2在一定条件下能直接生成氨:3CH4(g)+2N2(g)?700℃催化剂3C(s)+4NH3(g)△H>0,700℃时,n(CH4)n(N2)与CH4的平衡转化率的关系如图所示.下列判断正确的是( )
CH4、和N2在一定条件下能直接生成氨:3CH4(g)+2N2(g)?700℃催化剂3C(s)+4NH3(g)△H>0,700℃时,n(CH4)n(N2)与CH4的平衡转化率的关系如图所示.下列判断正确的是( )
 CH4、和N2在一定条件下能直接生成氨:3CH4(g)+2N2(g)?700℃催化剂3C(s)+4NH3(g)△H>0,700℃时,n(CH4)n(N2)与CH4的平衡转化率的关系如图所示.下列判断正确的是( )
CH4、和N2在一定条件下能直接生成氨:3CH4(g)+2N2(g)?700℃催化剂3C(s)+4NH3(g)△H>0,700℃时,n(CH4)n(N2)与CH4的平衡转化率的关系如图所示.下列判断正确的是( )| A. | n(CH4)n(N2)越大,CH4的转化率越高 | |
| B. | n(CH4)n(N2)与不变时,升温,NH3的体积分数会减小 | |
| C. | b点对应的平衡常数比a点的大 | |
| D. | a点对应的NH3的体积分数约为13% |
18.材料是人类赖以生存和发展的重要物质基础,有机玻璃(聚甲基丙烯酸甲酯)实际上不是硅酸盐材料,而是一种( )
| A. | 橡胶 | B. | 纤维 | C. | 塑料 | D. | 玻璃 |
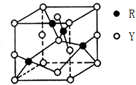 X、Y、Z、R为前四周期元素,原子序数依次增大.X、Y同周期,X基态原子的最外层电子数是次外层的2倍,Y基态原子的s能级和p能级上电子数相等;Z是地壳中含量最高的金属元素;R+离子的3d轨道全充满.
X、Y、Z、R为前四周期元素,原子序数依次增大.X、Y同周期,X基态原子的最外层电子数是次外层的2倍,Y基态原子的s能级和p能级上电子数相等;Z是地壳中含量最高的金属元素;R+离子的3d轨道全充满.