题目内容
标准状况下,等体积的NH3和CH4两种气体,下列有关说法错误的是
- A.所含分子数目相同
- B.所含氢原子物质的量之比为3:4
- C.质量之比为16:17
- D.密度之比为17:16
C
分析:标况下,气体摩尔体积为22.4L/mol,等体积的NH3和CH4两种气体的物质的量相等.
A、根据N=nNA= 计算所含分子数目;
计算所含分子数目;
B、根据气体的物质的量结合分子构成确定氢原子的物质的量;
C、根据m=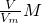 计算其质量之比;
计算其质量之比;
D、根据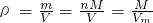 判断其密度之比.
判断其密度之比.
解答:标况下,气体摩尔体积为22.4L/mol.
A、根据N=nNA= 知,相同条件下,气体摩尔体积相同,气体的分子数与气体的体积成正比,所以相同体积的氨气和甲烷,所含分子数相同,故A正确;
知,相同条件下,气体摩尔体积相同,气体的分子数与气体的体积成正比,所以相同体积的氨气和甲烷,所含分子数相同,故A正确;
B、相同条件下,等体积的氨气和甲烷的物质的量相同,一个氨气分子中含有3个H,一个甲烷分子中含有4个H,所以所含氢原子物质的量之比为3:4,故B正确;
C、根据m=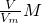 知,相同条件下,等体积的氨气和甲烷,其质量与相对分子质量成正比,所以其质量之比=17:16,故C错误;
知,相同条件下,等体积的氨气和甲烷,其质量与相对分子质量成正比,所以其质量之比=17:16,故C错误;
D、根据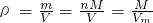 知,相同条件下,气体摩尔体积相同,气体的密度与相对分子质量成之比,所以其密度之比=1,7:16,故D正确.
知,相同条件下,气体摩尔体积相同,气体的密度与相对分子质量成之比,所以其密度之比=1,7:16,故D正确.
故选C.
点评:本题考查了阿伏伽德罗常数的定律及推论,难度不大,注意公式的运用理解与基础知识的掌握.
分析:标况下,气体摩尔体积为22.4L/mol,等体积的NH3和CH4两种气体的物质的量相等.
A、根据N=nNA=
 计算所含分子数目;
计算所含分子数目;B、根据气体的物质的量结合分子构成确定氢原子的物质的量;
C、根据m=
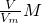 计算其质量之比;
计算其质量之比;D、根据
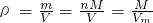 判断其密度之比.
判断其密度之比.解答:标况下,气体摩尔体积为22.4L/mol.
A、根据N=nNA=
 知,相同条件下,气体摩尔体积相同,气体的分子数与气体的体积成正比,所以相同体积的氨气和甲烷,所含分子数相同,故A正确;
知,相同条件下,气体摩尔体积相同,气体的分子数与气体的体积成正比,所以相同体积的氨气和甲烷,所含分子数相同,故A正确;B、相同条件下,等体积的氨气和甲烷的物质的量相同,一个氨气分子中含有3个H,一个甲烷分子中含有4个H,所以所含氢原子物质的量之比为3:4,故B正确;
C、根据m=
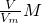 知,相同条件下,等体积的氨气和甲烷,其质量与相对分子质量成正比,所以其质量之比=17:16,故C错误;
知,相同条件下,等体积的氨气和甲烷,其质量与相对分子质量成正比,所以其质量之比=17:16,故C错误;D、根据
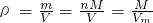 知,相同条件下,气体摩尔体积相同,气体的密度与相对分子质量成之比,所以其密度之比=1,7:16,故D正确.
知,相同条件下,气体摩尔体积相同,气体的密度与相对分子质量成之比,所以其密度之比=1,7:16,故D正确.故选C.
点评:本题考查了阿伏伽德罗常数的定律及推论,难度不大,注意公式的运用理解与基础知识的掌握.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目