题目内容
下图中A、B、C、D四条曲线分别表示ⅣA、ⅤA、ⅥA、ⅦA族元素的气态氢化物的沸点。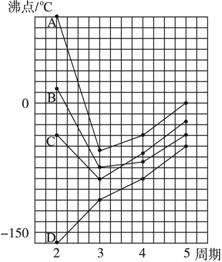
(1)表示ⅣA族元素气态氢化物沸点的曲线是________。
(2)表示ⅥA族元素气态氢化物沸点的曲线是__________。
(3)同一族中第三、四、五周期元素的气态氢化物沸点依次升高,其原因是______________。
(4)曲线中第二周期元素的气态氢化物的沸点显著高于同主族第三周期元素气态氢化物的沸点,其原因是____________________________________________________________。
解析:ⅣA、ⅤA、ⅥA、ⅦA族第二周期元素的气态氢化物分子式依次为CH4、NH3、H2O、HF,其中CH4分子间不存在氢键,沸点最低,对应于曲线D,而H2O的沸点最高,对应于曲线A。同一族中第三、四、五周期元素的气态氢化物分子间都不存在氢键,因组成和结构相似,分子间作用力随相对分子质量增大而增大,沸点依次升高。第二周期元素的气态氢化物分子间因存在较强的氢键,分子间作用力显著增大,使得沸点高于同一族中第三周期元素的气态氢化物的沸点。
答案:(1)D (2)A (3)同一族中第三、四、五周期元素的气态氢化物分子间都不存在氢键,因组成和结构相似,分子间作用力随相对分子质量依次增大而增大,沸点依次升高
(4)第二周期元素的气态氢化物分子间因存在较强的氢键,分子间作用力显著增大,使得沸点高于同一族中第三周期元素的气态氢化物的沸点

练习册系列答案
 小题狂做系列答案
小题狂做系列答案
相关题目
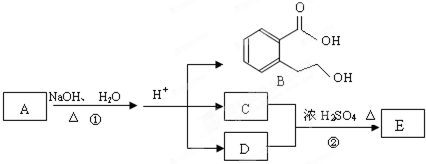

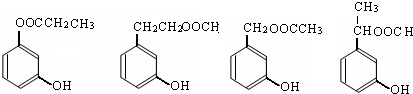 任意1种
任意1种





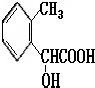
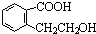
 CH2-CH2
CH2-CH2 n或CH2=CH2+H2O
n或CH2=CH2+H2O
