题目内容
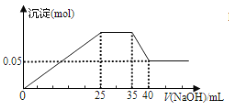
【题目】将 10mL0.2 mol·L-1 氯化铵溶液跟 25 mL0.05 mol·L-1 氢氧化钡溶液混合,则混合溶液中各离子浓度的大小顺序为
A. c(Cl-) >c(OH-) > c(NH4+)>c( Ba2+)
B. c(Cl-) >c(Ba2+) >c(OH-)>c(NH4+)
C. c(Ba2+) >c(Cl-) >c(OH-) >c(NH4+)
D. c(Cl-) >c(Ba2+)>c (NH4+) >c(OH-)
【答案】B
【解析】
先计算氯化铵和氢氧化钡的物质的量,再利用氯化铵和氢氧化钡的反应来分析反应后所得溶液中各种离子的物质的量的多少。
10mL0.2 mol·L-1 氯化铵溶液中硝酸铵的物质的量为10mL×10-3L×0.2mol/L=0.002mol,
25 mL0.05 mol·L-1氢氧化钡溶液中氢氧化钡的物质的量为25mL×10-3L×0.05mol/L=0.00125mol,
氯化铵和氢氧化钡混合以后发生反应:2NH4Cl+Ba(OH)2=BaCl2+2NH3![]() H2O,
H2O,
则反应后,35mL溶液的组成为:剩余氢氧化钡0.00025,生成的氯化钡0.001mol,生成的一水合氨0.002mol,
在体积一样的前提下,物质的量越大,浓度越大,故c(Cl-) >c(Ba2+),
而氨水能电离出少量且相等的铵根和氢氧根,氢氧化钡中还有0.0005mol的氢氧根,所以c(OH-) >c(NH4+),
故离子浓度大小顺序为:c(Cl-) >c(Ba2+) >c(OH-)>c(NH4+)。
所以B选项是正确的。

 名师指导一卷通系列答案
名师指导一卷通系列答案【题目】如表为元素周期表的一部分,标出了A—K共十种元素所在位置。请用元素符号或化学式回答下列问题.
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | A | B | ||||||
3 | C | D | E | F | G | |||
4 | H | I | K |
(1)10种元素中,化学性质最不活泼的是______,最活泼的金属是_____。
(2)C、E、F三种元素形成的简单离子半径最小的是_______。
(3)C、K形成的化合物中化学键的类型属于________
(4)化合物C2B2的电子式为__________________;该化合物和AB2反应的化学方程式为__________________________________________。
(5)E的最高价氧化物属于________________性氧化物,它与氢氧化钠溶液反应的离子方程式为____________________________________________。
(6)D的单质在A、B形成化合物中燃烧的化学方程式为________________________。
(7)用电子式表示H与B组成的H2B型化合物的形成过程:_____________________。