题目内容
(7分)分别取40mL的0.50 mol/L盐酸与40mL的0.55 mol/L氢氧化钠溶液进行中和反应。通过测定反应过程中所放出的热量可计算中和热。请回答下列问题。
(1)理论上稀强酸、稀强碱反应生成1 mol 水时放出57.3 kJ的热量,写出表示稀硫酸和稀氢氧化钠溶液反应的中和热的热化学方程式__________________________________。
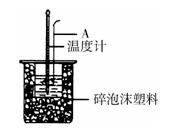
(2)如图所示,A为泡沫塑料板,上面有两个小孔,分别插入温度计和环形玻璃搅拌棒,两个小孔不能开得过大,其原因是_____________________________________________;
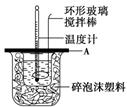
(3)假设盐酸和氢氧化钠溶液的密度都是1 g/cm3,又知中和后生成溶液的比热容c=4.18 J/(g·℃)。为了计算中和热,实验时还需测量的数据有(填序号)________。
A.反应前盐酸溶液的温度
B.反应前盐酸溶液的质量
C.反应前氢氧化钠溶液的温度
D.反应前氢氧化钠溶液的质量
E.反应后混合溶液的最高温度
F.反应后混合溶液的质量
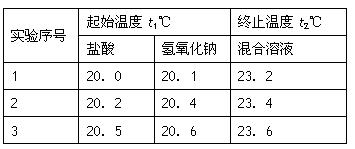
(4)某学生实验记录数据如下:
|
实验 序号 |
起始温度t1/℃ |
终止温度t2/℃ |
|
|
盐酸 |
氢氧化钠 |
混合溶液 |
|
|
1 |
20.0 |
20.1 |
23.2 |
|
2 |
20.2 |
20.4 |
23.4 |
|
3 |
20.5 |
20.6 |
23.6 |
依据该学生的实验数据计算,该实验测得的中和热ΔH=________;
(1)NaOH(aq)+H2SO4(aq)===Na2SO4(aq)+H2O(l) ΔH=-57.3 kJ/mol(2分)
(2)减少热量损失(1分)
(3)ACE(2分) (4)-51.8 kJ/mol (2分)
【解析】(1)在稀水溶液中,酸碱中和生成盐和1mol水时放出的热量;
(2)因该反应要测反应中放出的热量,为提高实验结果的准确性,故当然要减少热量损失;
(3)利用关系式:Q=-C(T2-T1),可以看出:选ACE;
(4)以第一组实验为例:t1=(20.0+20.1)/2=20.05℃,则公式中(T2-T1)=23.2-20.05=3.15℃;
同理,第二组实验中,(T2-T1)=3.1℃;第三组实验中,(T2-T1)=3.05℃;
则三组实验的(T2-T1)平均值为3.1℃,带入关系式,得:
Q=-4.18 J/(g·℃)×80 g×3.1℃=1.03664KJ
则生成1mol水时放出的热量=1.03664KJ÷0.02mol×1mol=51.8 KJ,即ΔH=-51.8 kJ/mol

 名校课堂系列答案
名校课堂系列答案
 分别取40mL的0.50mol/L盐酸与40mL的0.55mol/L氢氧化钠溶液进行中和反应.通过测定反应过程中所放出的热量可计算中和热.请回答下列问题.
分别取40mL的0.50mol/L盐酸与40mL的0.55mol/L氢氧化钠溶液进行中和反应.通过测定反应过程中所放出的热量可计算中和热.请回答下列问题.