题目内容
5.经实验测定,在4℃时,水的密度最大,为1g•mL-1,请计算一下,4℃时1L水中含有的水分子数为3.344×1025,每个水分子的质量为3.0×10-23g.分析 4℃时1L水中含有的水的质量为1000g,结合n=$\frac{N}{{N}_{A}}$计算.
解答 解:在4℃时,水的密度最大,为1g•mL-1,1L水中含有的水的质量为1000g,n=$\frac{1000g}{18g/mol}$=55.56mol,N=55.56mol×6.02×1023/mol=3.344×1025,
每个水分子的质量为$\frac{1000g}{3.344×1{0}^{25}}$=3.0×10-23g,
故答案为:3.344×1025;3.0×10-23g.
点评 本题考查物质的量的计算,为高频考点,侧重于学生的分析、计算能力的考查,注意把握相关计算公式的运用,难度不大.

练习册系列答案
相关题目
15.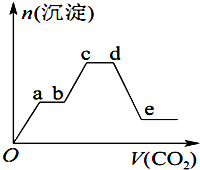 将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀的物质的量与所通入CO2的体积关系如图所示.下列关于整个反应过程中的叙述错误的是( )
将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀的物质的量与所通入CO2的体积关系如图所示.下列关于整个反应过程中的叙述错误的是( )
 将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀的物质的量与所通入CO2的体积关系如图所示.下列关于整个反应过程中的叙述错误的是( )
将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀的物质的量与所通入CO2的体积关系如图所示.下列关于整个反应过程中的叙述错误的是( )| A. | Oa段反应的化学方程式是Ba(OH)2+CO2═BaCO3↓+H2O | |
| B. | bc段与cd段所消耗CO2的体积相同 | |
| C. | bc段反应的离子方程式是2AlO${\;}_{2}^{-}$+3H2O+CO2═2Al(OH)3↓+CO${\;}_{3}^{2-}$ | |
| D. | de段沉淀减少是由于BaCO3固体的消失 |
16.常温下有0.1mol/L的以下几种溶液,①H2SO4溶液,②NaHSO4溶液,③CH3COOH溶液,④HCl溶液,⑤HCN溶液,⑥NH3•H2O,其中如下几种溶液的电离度(即已经电离的占原来总的百分数)如下表(已知H2SO4的第一步电离是完全的),回答下面问题:
(1)常温下,pH相同的表格中几种溶液,其物质的量浓度由大到小的顺序是③>②>④>①(填序号,下同)
(2)常温下,将足量的锌粉投人等体积pH=1的表格中几种溶液中,产生H2的体积(同温同压下)由大到小的顺序是③>②>①>④
(3)在25℃时,若用已知浓度的NaOH滴定未知浓度的CH3 COOH,若终点时溶液pH=a,则由水电离的.c(H+)为10-amol/L.
(4)25℃时,将amol NH4NO3溶于水,溶液显酸性,向该溶液滴加bL氨水后溶液呈中性,则滴加氨水的过程中的水的电离平衡将逆向(填“正向”“不”或“逆向”)移动,所滴加氨水的浓度为$\frac{a}{200b}$mol•L-1.(NH3•H2O的电离平衡常数取Kb=2X10-5 mol•L-1)
| ①H2SO4溶液HSO4- | ②NaHSO4溶液HSO4- | ③CH3COOH | ④HCl溶液 |
| 10% | 29% | 1.33% | 100% |
(2)常温下,将足量的锌粉投人等体积pH=1的表格中几种溶液中,产生H2的体积(同温同压下)由大到小的顺序是③>②>①>④
(3)在25℃时,若用已知浓度的NaOH滴定未知浓度的CH3 COOH,若终点时溶液pH=a,则由水电离的.c(H+)为10-amol/L.
(4)25℃时,将amol NH4NO3溶于水,溶液显酸性,向该溶液滴加bL氨水后溶液呈中性,则滴加氨水的过程中的水的电离平衡将逆向(填“正向”“不”或“逆向”)移动,所滴加氨水的浓度为$\frac{a}{200b}$mol•L-1.(NH3•H2O的电离平衡常数取Kb=2X10-5 mol•L-1)
13.下列分子为直线形分子且分子中原子都满足8电子稳定结构的是( )
| A. | BeF2 | B. | C2H2 | C. | SO2 | D. | CO2 |
20.CH3-CH2-${\;}_{\;}^{16}$OH、CH3-CH2-${\;}_{\;}^{18}$OH分别与CH3COOH反应,生成的酯的相对分子质量大小关系( )
| A. | 前者大于后者 | B. | 前者小于后者 | C. | 前者等于后者 | D. | 无法确定 |
17.为分别验证温度、浓度、催化剂颗粒大小对化学反应速率的影响规律,某同学设计了如下4组实验.
(1)上表中,反应速率最快的是实验2(填实验编号).
(2)实验3、4预期可得出的结论是催化剂颗粒越小,化学反应速率越大.
(3)设计实验2、3的目的是探究浓度对化学反应速率的影响.
(4)设计一个实验证明在其他条件相同时,改变温度对过氧化氢分解速率的影响(写出操作步骤):取相同浓度的过氧化氢溶液,控制催化剂相同,分别在在不同温度下加热,观察产生气体的快慢.
| 实验序号 | 温度 /℃ | H2O2溶液 初始浓度/% | MnO2 颗粒大小 |
| 1 | 25 | 4 | 无MnO2 |
| 2 | 25 | 12 | 1g细颗粒MnO2 |
| 3 | 25 | 4 | 1g细颗粒MnO2 |
| 4 | 25 | 4 | 1g粗颗粒MnO2 |
(2)实验3、4预期可得出的结论是催化剂颗粒越小,化学反应速率越大.
(3)设计实验2、3的目的是探究浓度对化学反应速率的影响.
(4)设计一个实验证明在其他条件相同时,改变温度对过氧化氢分解速率的影响(写出操作步骤):取相同浓度的过氧化氢溶液,控制催化剂相同,分别在在不同温度下加热,观察产生气体的快慢.
14.下列溶液蒸干后,能析出溶质固体的是( )
①AlCl3 ②Fe2(SO4)3 ③Ca(HCO3)2 ④Na2CO3.
①AlCl3 ②Fe2(SO4)3 ③Ca(HCO3)2 ④Na2CO3.
| A. | 仅①④ | B. | 仅②④ | C. | 仅①② | D. | 全部 |
15.下列物质中同分异构体(不考虑立体异构)最多的是( )
| A. | 乙醇 | B. | 戊烷 | C. | 二氯丙烷 | D. | 戊烯 |