题目内容
【题目】如图所示,组成一种原电池.试回答下列问题:

(1)电解质溶液为稀H2SO4时,若灯泡亮,则Mg电极上发生的反应为:______________;溶液的pH______(填“增大”、“减小”或“不变”).
(2)电解质溶液为NaOH(aq)时,若灯泡亮,则Mg电极为电池的______极(填“正”或“负”).若产生标况下33.6L气体,则溶液增重______g
(3)再次更换一种电解质溶液,组成原电池,使得溶液质量减少,请写出一种可能的电解质溶液_________ 。
【答案】 Mg-2e-=Mg2+ 增大 正 24 CuSO4 溶液( 合理即可)
【解析】试题分析:(1)镁的活泼性大于铝,电解质溶液为稀H2SO4时,镁是负极;(2)铝能与氢氧化钠反应,电解质溶液为NaOH(aq)时,铝是负极、镁是正极;
(3)溶液质量减少,说明溶液中有金属析出,且析出金属的质量大于镁溶解的质量。
解析:(1)①分析题给装置图,当电解质溶液为稀H2SO4时上述装置中灯泡亮,则形成原电池,镁较活泼,作原电池的负极,则Mg电极上发生的反应为Mg-2e-=Mg2+,铝电极上的反应是2H+ + 2e- = H2↑,溶液中氢离子浓度降低,pH增大;
(2)电解质溶液为NaOH溶液时,Al片作负极,Mg片作正极,Mg电极上发生的电极反应式为6H2O + 6e- = 6OH- + 3H2↑;
总反应为2Al + 2OH-+2H2O =2AlO2- + 3H2 ;设溶液增重xg;
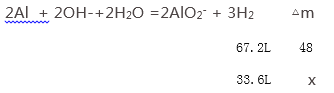
![]() ,x=24g
,x=24g
(3)溶液质量减少,说明溶液中有金属析出,且析出金属的质量大于镁溶解的质量,若溶质为硫酸铜,根据![]() ,溶解24g镁生成64g铜,溶液质量减少。
,溶解24g镁生成64g铜,溶液质量减少。

练习册系列答案
相关题目
