题目内容
【题目】回答下列问题:
(1)CuSO4的水溶液呈______(填“酸”“中”或“碱”)性,原因是(用离子方程式表示)___________;实验室在配制CuSO4溶液时,常先将CuSO4固体溶于较浓的硫酸中,然后用蒸馏水稀释到所需的浓度,以_____ (填“促进”或“抑制”)其水解。
(2)泡沫灭火器的灭火原理是(用离子方程式表示)________________________。
(3)已知在25℃:AgCl(s)![]() Ag+(aq)+Cl-(aq) Ksp=1.8×10-10,Ag2S(s)
Ag+(aq)+Cl-(aq) Ksp=1.8×10-10,Ag2S(s) ![]() 2Ag+(aq)+S2-(aq) Ksp=6.3×10-50,向浓度均为0.001 mol/L的NaCl和Na2S的混合溶液中,逐滴加入AgNO3溶液,最先产生的沉淀是________(填“AgCl”或“Ag2S”)。
2Ag+(aq)+S2-(aq) Ksp=6.3×10-50,向浓度均为0.001 mol/L的NaCl和Na2S的混合溶液中,逐滴加入AgNO3溶液,最先产生的沉淀是________(填“AgCl”或“Ag2S”)。
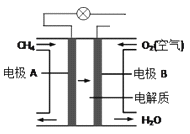
(4)燃料电池能量转化率高,具有广阔的发展前景。天然气燃料电池中,在负极发生反应的物质是 _____(填化学式);如果该电池中的电解质溶液是KOH溶液,电极B电极上发生的电极反应式是:_____________。
【答案】酸 Cu2++2H2O≒Cu(OH)2+2H+ 抑制 Al3++3HCO3-=3CO2↑+Al(OH)3↓ Ag2S CH4 O2+4e-+2H2O=4OH-
【解析】
(1)CuSO4是强酸弱碱盐,铜离子水解方程式为Cu2++2H2OCu(OH)2+2H+,水解后溶液中c(H+)>c(OH-),所以溶液呈酸性,即常温下pH<7;为防止CuSO4水解,所以配制CuSO4溶液时将CuSO4先溶于较浓的硫酸中,抑制其水解,然后稀释,故答案为:酸;Cu2++2H2OCu(OH)2+2H+;抑制;
(2)HCO3-和Al3+均可发生双水解反应,产生气体CO2和沉淀Al(OH)3,离子方程式为Al3++3HCO3-=Al(OH)3↓+3CO2↑,故答案为:Al3++3HCO3-═3CO2↑+Al(OH)3↓;
(3)由于25℃:AgCl(s)![]() Ag+(aq)+Cl-(aq) Ksp=1.8×10-10,Ag2S(s)
Ag+(aq)+Cl-(aq) Ksp=1.8×10-10,Ag2S(s) ![]() 2Ag+(aq)+S2-(aq) Ksp=6.3×10-50,浓度均为0.001 mol/L的NaCl和Na2S的混合溶液,c(Cl-)= c(S2-),要产生氯化银沉淀,需要c(Ag+)=
2Ag+(aq)+S2-(aq) Ksp=6.3×10-50,浓度均为0.001 mol/L的NaCl和Na2S的混合溶液,c(Cl-)= c(S2-),要产生氯化银沉淀,需要c(Ag+)=![]() =1.8×10-7mol/L,要产生硫化银沉淀,需要c(Ag+)=
=1.8×10-7mol/L,要产生硫化银沉淀,需要c(Ag+)=![]() =
=![]() ×10-24mol/L,因此逐滴加入AgNO3溶液,最先产生的沉淀是硫化银,故答案为:Ag2S;
×10-24mol/L,因此逐滴加入AgNO3溶液,最先产生的沉淀是硫化银,故答案为:Ag2S;
(4)燃料电池中,通入燃料的为负极,通入氧气或空气的为正极。天然气燃料电池中,在负极发生反应的物质为甲烷;在电解质溶液为KOH溶液时,正极的电极反应式为O2+4e-+2H2O=4OH-,故答案为:CH4;O2+4e-+2H2O=4OH-。

 名校课堂系列答案
名校课堂系列答案