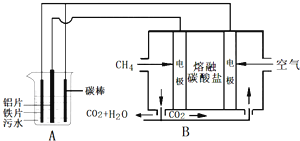
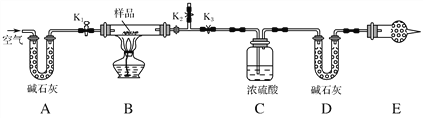
题目内容
【题目】按化学反应中元素化合价是否发生变化,无机反应可以分为氧化还原反应和非氧化还原反应.这种分类方法与将无机反应按反应形式的不同分为四种基本反应类型是完全不同的分类方式,这二者的关系如图.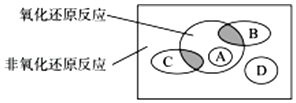
图中方框内区域表示所有的化学反应,大圆内区域表示氧化还原反应,大圆外区域表示非氧化还原反应,其中A~D分别表示四种基本反应类型.请分别填出:
(1)化学反应可以分为哪四种基本反应类型:、、、 .
(2)若图中B圈表示化合反应,则:
B圈与氧化还原反应重叠的阴影部分表示哪一类反应?;
C圈与氧化还原反应重叠的阴影部分表示哪一类反应?;
请分别举出符合以上两种情况的一个例子:; .
(3)下列说法正确的是 .
A.置换反应一定属于氧化还原反应
B.有单质参加和有单质生成的化学反应一定是氧化还原反应
C.化学反应中有一种物质被氧化,必定有另外一种物质被还原
D.氧化还原反应发生的本质是化合价发生了变化.
【答案】
(1)置换反应,化合反应,分解反应,复分解反应
(2)有元素化合价变化的化合反应,有元素化合价变化的分解反应,Cl2+2FeCl2=2FeCl3,2KClO3 ![]() 2KCl+3O2↑
2KCl+3O2↑
(3)A
【解析】解:(1)置换反应一定属于氧化还原反应,复分解反应一定不属于氧化还原反应,有元素化合价变化的分解反应属于氧化还原反应,有元素化合价变化的化合反应属于氧化还原反应,所以化合反应和分解反应与氧化还原反应属于交叉关系,置换反应被氧化还原反应包含,复分解反应和氧化还原反应既不交叉也不被包含,若B表示化合反应,则C表示分解反应,A表示置换反应,D表示复分解反应,
故答案为:置换反应;化合反应;分解反应;复分解反应;
(2)B圈与氧化还原反应重叠的阴影部分表示既是氧化还原反应又是化合反应,则为有元素化合价变化的化合反应,如:Cl2+2FeCl2=2FeCl3;C圈与氧化还原反应重叠的阴影部分表示既是分解反应又是氧化还原反应,则为有元素化合价变化的分解反应,如:2KClO3 ![]() 2KCl+3O2↑,
2KCl+3O2↑,
故答案为:有元素化合价变化的化合反应;有元素化合价变化的分解反应;Cl2+2FeCl2=2FeCl3;2KClO3 ![]() 2KCl+3O2↑;
2KCl+3O2↑;
(3)A.置换反应一定有化合价变化,则属于氧化还原反应,故A正确;
B.同素异形体之间的转化有单质生成或有单质参加,但无化合价变化,不属于氧化还原反应,故B错误;
C.氧化还原反应可发生在同一物质之间,如在Cl2+H2O=HCl+HClO反应中,既是氧化剂,又是还原剂,故C错误;
D.氧化还原反应发生的本质是电子转移,故D错误;
故选A.
根据四大基本反应类型与氧化还原反应的关系以及氧化还原反应的规律进行分析即可.

【题目】化学反应原理在科研和生产中有广泛应用。
(1)用生物质热解气(主要成分为CO、CH4、H2)将SO2在一定条件下还原为单质硫进行烟气脱硫。已知:
①C(s)+O2(g)=CO2(g) △H1=-393.5 kJ·mol-1
②CO2(g)+C(s)=2CO(g) △H2= + 172.5 kJ·mol-1
③S(s)+O2(g)=SO2(g) △H3=- 296.0 kJ·mol-1
CO将SO2 还原为单质硫的热化学方程式为_____________________________________。
(2)CO可用于合成甲醇,一定温度下,向体积为2 L的密闭容器中加入CO和H2,发生反应CO(g)+2H2(g)![]() CH3OH(g),达到平衡后测得各组分的浓度如下:
CH3OH(g),达到平衡后测得各组分的浓度如下:
物质 | CO | H2 | CH3OH |
浓度(mol·L-1) | 0.9 | 1.0 | 0.6 |
①反应达到平衡时,CO的转化率为_______________。
②该反应的平衡常数K=________________。
③恒温恒容条件下,可以说明反应已达到平衡状态的是__________(填标号)。
A.v正(CO)=2v逆(H2) B.混合气体的密度不变
C.混合气体的平均相对分子质量不变 D.CH3OH、CO、H2的浓度都不再发生变化
④若将容器体积压缩到1L,则达到新平衡时c(H2)的取值范围是_____________。
⑤若保持容器体积不变,再充入0.6molCO和0.4molCH3OH,此时v正__________v逆(填“>”<”或“=”)。
(3)常温下,HNO2的电离常数Ka=7.1×10-4mol·L-1,NH3·H2O的电离常数Kb=1.7×10-5mol·L-1。0.1mol·L-1NH4NO2溶液中离子浓度由大到小的顺序是__________,常温下NO2-水解反应的平衡常数Kb=__________(保留两位有效数字)。