题目内容
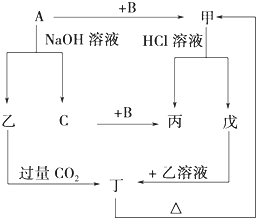 由短周期元素组成的单质A、B、C和甲、乙、丙、丁、戊五种化合物有如图所示的转换关系,甲是工业上制取A的主要原料.请回答:
由短周期元素组成的单质A、B、C和甲、乙、丙、丁、戊五种化合物有如图所示的转换关系,甲是工业上制取A的主要原料.请回答:(1)写出下列物质的化学式:
A
Al
Al
,乙NaAlO2
NaAlO2
.(2)写出甲物质在工业上的任意两种主要用途
作耐高温材料;制取铝单质
作耐高温材料;制取铝单质
;(3)A与NaOH溶液反应的离子方程式:
2Al+2OH-+2H2O═2AlO2-+3H2↑
2Al+2OH-+2H2O═2AlO2-+3H2↑
;(4)戊溶液与乙溶液混合的离子方程式:
Al3++3AlO2-+6H2O═4Al(OH)3↓
Al3++3AlO2-+6H2O═4Al(OH)3↓
.分析:本题的“突破口”是单质A与NaOH溶液反应,生成单质C,则C为H2,A可能是铝或硅,则乙为偏铝酸钠或硅酸钠,与过量的二氧化碳反应生成丁为氢氧化铝或硅酸,丁加热分解得到甲为氧化铝或二氧化硅,由于甲与盐酸反应,故甲为氧化铝,则A为Al,B为O2,乙为偏铝酸钠、丁为氢氧化铝,结合转化故选可知,丙为水、戊为氯化铝,据此解答.
解答:解:本题的“突破口”是单质A与NaOH溶液反应,生成单质C,则C为H2,A可能是铝或硅,则乙为偏铝酸钠或硅酸钠,与过量的二氧化碳反应生成丁为氢氧化铝或硅酸,丁加热分解得到甲为氧化铝或二氧化硅,由于甲与盐酸反应,故甲为氧化铝,则A为Al,B为O2,乙为偏铝酸钠、丁为氢氧化铝,结合转化故选可知,丙为水、戊为氯化铝,
(1)由上述分析可知,A为Al,乙为NaAlO2,
故答案为:Al;NaAlO2;
(2)甲是氧化铝,在工业上可以作耐高温材料、制取铝单质等,
故答案为:作耐高温材料、制取铝单质;
(3)Al与NaOH溶液反应的离子方程式为:2Al+2OH-+2H2O═2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O═2AlO2-+3H2↑;
(4)氯化铝溶液与偏铝酸钠溶液混合的离子方程式为:Al3++3AlO2-+6H2O═4Al(OH)3↓,
故答案为:Al3++3AlO2-+6H2O═4Al(OH)3↓.
(1)由上述分析可知,A为Al,乙为NaAlO2,
故答案为:Al;NaAlO2;
(2)甲是氧化铝,在工业上可以作耐高温材料、制取铝单质等,
故答案为:作耐高温材料、制取铝单质;
(3)Al与NaOH溶液反应的离子方程式为:2Al+2OH-+2H2O═2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O═2AlO2-+3H2↑;
(4)氯化铝溶液与偏铝酸钠溶液混合的离子方程式为:Al3++3AlO2-+6H2O═4Al(OH)3↓,
故答案为:Al3++3AlO2-+6H2O═4Al(OH)3↓.
点评:本题考查无机物的推断,涉及铝单质及其化合物的性质,掌握铝单质及化合物性质是关键,单质A与NaOH溶液反应是“突破口”,难度不大.

练习册系列答案
 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案
相关题目






 北京奥运会主会场“鸟巢”内灯火辉煌,鼓瑟齐鸣.璀璨的烟花在空中组成奥运五环等图案,与场内表演相呼应.请回答下列问题:
北京奥运会主会场“鸟巢”内灯火辉煌,鼓瑟齐鸣.璀璨的烟花在空中组成奥运五环等图案,与场内表演相呼应.请回答下列问题: