题目内容
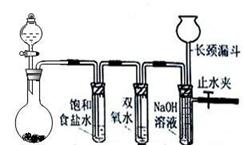
CaCO3广泛存在于自然界,是一种重要的化工原料。大理石主要成分为CaCO3,另外有少量的含硫化合物(如FeS等)。实验室用大理石和稀盐酸反应制备CO2气体。下列装置可用于CO2气体的提纯和干燥。
完成下列填空:
(1)用浓盐酸配制1∶1(体积比)的稀盐酸(约6 mol·L-1),应选用的仪器是_____。
a.烧杯 b.玻璃棒 c.量筒 d.容量瓶
(2)上述装置中,A是_____溶液,NaHCO3溶液可以吸收_____。
(3)上述装置中,B物质是_____。把这个实验得到的气体收集起来,用来测定CO2的分子量,如果B物质失效,测定结果_____(填“偏高”、“偏低”或“不受影响”)。
(4)一次性饭盒中石蜡(高级烷烃)和CaCO3在食物中的溶出量是评价饭盒质量的指标之一,测定溶出量的主要实验步骤设计如下:
剪碎、称重→浸泡溶解→过滤→残渣烘干→冷却、称重→恒重,为了将石蜡溶出,应选用的试剂是_____,碳酸钙溶出,应选用的试剂是_____。
a.氯化钠溶液 b.稀醋酸
c.稀硫酸 d.正己烷
(5)在溶出量测定实验中,为了获得石蜡和碳酸钙的最大溶出量,应先溶出_____,原因是_______________。
(1)a、b、c
(2)CuSO4或酸性KMnO4 HCl气体或酸性气体
(3)无水CaCl2 偏低
(4)d b
(5)石蜡 醋酸中的乙酸也是有机物,也能溶解石蜡,为防止石蜡损失,一般先溶出石蜡再溶出CaCO3
解析

练习册系列答案
 金钥匙试卷系列答案
金钥匙试卷系列答案
相关题目
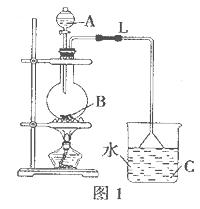
Ⅰ. 在实验室利用下列装置,可制备某些气体并验证其化学性质。
完成下列表格:
| 序号 | 气体 | 装置连接顺序(填字母) | 制备反应的化学方程式 |
| (1) | 乙烯 | _________________ | _________________ |
| (2) | 乙炔 | A→C→E | _________________ |
经查阅有关资料得知H2S、PH3能与硫酸铜溶液反应,相关仪器和药品装置图如下:

(1)按气体从左到右的流向选择最佳的装置组合是(选填字母序号):_________
(2)为保证测定的精度,要求产生乙炔的气流较为平缓,在分液漏斗中应装入的液体是________________。
(3)若电石样品的质量为m1g,F吸收乙炔前后的质量差为m2g,则电石样品中CaC2质量分数
 =_______________。
=_______________。 


 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O