题目内容
11.下列事实不能用勒沙特列原理解释的是:( )| A. | 新制的氯水在光照条件下颜色变浅 | |
| B. | 加入催化剂可以加快合成氨的速率 | |
| C. | 实验室中常用排饱和食盐水的方法收集氯气 | |
| D. | 工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率 |
分析 勒夏特列原理为:如果改变影响平衡的条件之一,平衡将向着能够减弱这种改变的方向移动;使用勒夏特列原理时,研究对象必须为可逆反应,否则勒夏特列原理不适用.
解答 解:A.氯水中存在平衡Cl2+H2O?HClO+H++Cl-,光照HClO分解,溶液中HClO浓度降低,平衡向生成HClO方向移动,可用平衡移动原理解释,故A不选;
B.催化剂只能改变反应速率不影响平衡移动,所以催化剂不能用平衡移动原理解释,故B选;
C.氯化钠在溶液中完全电离,所以饱和食盐水中含有大量的氯离子,氯气溶于水的反应是一个可逆反应,Cl2+H2O?ClO-+2H++Cl-,由于饱和食盐水中含有大量的氯离子,相当于氯气溶于水的反应中增加了大量的生成物氯离子,根据勒夏特列原理,平衡向逆反应方向移动,氯气溶解量减小,所以可以平衡移动原理解释,故C不选;
D.工业上生产硫酸的过程中使用过量的空气,平衡正向移动,从而提高二氧化硫的利用率,可以用平衡移动原理解释,故D不选;
故选B.
点评 本题考查化学平衡移动原理,为高频考点,明确平衡移动原理内涵是解本题关键,注意使用勒夏特列原理的前提必须是可逆反应,不改变平衡移动的因素不能用平衡移动原理解释,题目难度不大.

练习册系列答案
相关题目
1.下表列出了除去物质中所含少量杂质的方法,其中正确的是( )
| 物质 | 所含杂质 | 除去杂质的方法 | |
| A | CO气体 | CO2 | 通过足量氢氧化钠溶液,并干燥 |
| B | NaOH溶液 | Na2CO3 | 加入足量稀盐酸至不再产生气泡 |
| C | CaO固体 | CaCO3 | 加水溶解,过滤 |
| D | FeSO4溶液 | CuSO4 | 加入足量锌粒,充分反应,过滤 |
| A. | A | B. | B | C. | C | D. | D |
2.下列实验现象描述不正确的是( )
| 选项 | 实 验 | 现 象 |
| A | 加热放在坩埚中的小块钠 | 钠先熔化成光亮的小球,燃烧时,火焰为黄色,燃烧后,生成淡黄色固体 |
| B | 在酒精灯上加热铝箔 | 铝箔熔化,失去光泽,熔化的铝并不滴落,好像有一层膜兜着 |
| C | 在FeCl2溶液中滴入NaOH溶液 | 先生成白色沉淀,沉淀很快变为灰绿色,最后变为红褐色 |
| D | 在空气中久置的铝条放入NaOH溶液中 | 立刻产生大量无色气泡,铝条逐渐变细,铝条逐渐发热 |
| A. | A | B. | B | C. | C | D. | D |
19.青石棉是一种致癌物质,是《鹿特丹公约》中受限制的46种化学品之一,其化学式为Na2Fe5Si8O22(OH)2.青石棉用稀硝酸溶液处理时,还原产物只有NO,下列说法不正确的是( )
| A. | 青石棉是一种硅酸盐材料 | |
| B. | 青石棉中含有一定量的石英晶体 | |
| C. | 青石棉的化学组成可表示为Na2O•3FeO•Fe2O3•8SiO2•H2O | |
| D. | 1mol青石棉能使1molHNO3被还原 |
6.下列反应的离子方程式,书写正确的是( )
| A. | 氢氧化钠溶液与盐酸反应:OH-+H+═H2O | |
| B. | H2SO4溶液中滴入Ba(OH)2溶液:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| C. | 氧化镁与稀盐酸混合:MgO+2H+═Mg2++H2O | |
| D. | 氢氧化钡溶液与硫酸铜溶液反应:Ba2++SO42-═BaSO4↓ |
20.铝热反应是铝的一个重要性质,该性质用途十分广泛,不仅被用于焊接钢轨,而且还常被用于冶炼高熔点的金属如钒、铬、锰等.
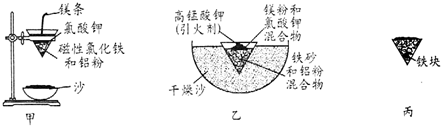
(1)某校化学兴趣小组同学,取磁性氧化铁按教材中的实验装置(如图甲)进行铝热反应,现象很壮观.取反应后的“铁块”溶于盐酸,向其中滴加KSCN溶液,发现溶液变血红色.出现这种现象的原因,除了可能混有没反应完的磁性氧化铁外,还有一个原因是熔融的铁被空气中氧气氧化.
(2)若证明上述所得“铁块”中含有金属铝,可选择氢氧化钠溶液(填试剂名称)进行实验,所发生反应的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑.
(3)为克服图甲的缺陷改用图乙装置进行铝热反应.取反应后的“铁块”溶于盐酸,向其中滴加KSCN溶液,溶液没有出现血红色.为测定该实验所得“铁块”的成分,实验流程如图所示.

几种氢氧化物开始沉淀和完全沉淀的pH如下表所示.
①试剂A应选择C,试剂B应选择D.(填序号)
A.稀盐酸 B.氧化铁 C.H2O2溶液 D.氨水 E.MgCO3固体
②已知常温下Fe(OH)3的Ksp=1.1×10-36,则反应Ⅲ后溶液中c(Fe3+)=1.1×10-6mol•L-1.
③灼烧完全的标志是前后两次灼烧质量相差不大于0.1g.
④若最终红色粉未M的质量为12.0g,则该“铁块”的纯度是84%.如果对所得过滤固体直接洗涤、烘干、称量,计算“铁块”的纯度,则计算结果会偏小(填“偏大”“偏小”或“无影响”)原因是Fe(OH)3在烘干过程中会有部分发生分解反应,质量变小.

(1)某校化学兴趣小组同学,取磁性氧化铁按教材中的实验装置(如图甲)进行铝热反应,现象很壮观.取反应后的“铁块”溶于盐酸,向其中滴加KSCN溶液,发现溶液变血红色.出现这种现象的原因,除了可能混有没反应完的磁性氧化铁外,还有一个原因是熔融的铁被空气中氧气氧化.
(2)若证明上述所得“铁块”中含有金属铝,可选择氢氧化钠溶液(填试剂名称)进行实验,所发生反应的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑.
(3)为克服图甲的缺陷改用图乙装置进行铝热反应.取反应后的“铁块”溶于盐酸,向其中滴加KSCN溶液,溶液没有出现血红色.为测定该实验所得“铁块”的成分,实验流程如图所示.

几种氢氧化物开始沉淀和完全沉淀的pH如下表所示.
| Fe2+ | Fe3+ | Al3+ | Mg2+ | |
| 开始沉淀时的pH | 7.5 | 2.8 | 4.2 | 9.6 |
| 沉淀完全时的pH | 9.0 | 4.0 | 5 | 11 |
A.稀盐酸 B.氧化铁 C.H2O2溶液 D.氨水 E.MgCO3固体
②已知常温下Fe(OH)3的Ksp=1.1×10-36,则反应Ⅲ后溶液中c(Fe3+)=1.1×10-6mol•L-1.
③灼烧完全的标志是前后两次灼烧质量相差不大于0.1g.
④若最终红色粉未M的质量为12.0g,则该“铁块”的纯度是84%.如果对所得过滤固体直接洗涤、烘干、称量,计算“铁块”的纯度,则计算结果会偏小(填“偏大”“偏小”或“无影响”)原因是Fe(OH)3在烘干过程中会有部分发生分解反应,质量变小.
1.下列关于乙烯的说法正确的是( )
| A. | 是天然气的主要成分 | B. | 能使溴的四氯化碳溶液褪色 | ||
| C. | 不能发生燃烧反应 | D. | 不能发生加聚反应 |