题目内容
【题目】综合利用CO2、CO对构建低碳社会有重要意义。
(1)已知在298K和101kPa条件下,有如下反应:
反应Ⅰ:C(s) + O2(g) = CO2(g) △ H1=-393.5 kJ·mol-1
反应Ⅱ:2C(s) + O2(g) = 2CO(g) △ H2=-221 kJ·mol-1
反应Ⅲ:N2(g) + O2(g) = 2NO(g) △ H3=+180.5 kJ·mol-1
试回答下列问题:
①汽车尾气净化原理为反应Ⅳ:2NO(g) + 2CO(g) ![]() N2(g) + 2CO2(g) △ H=______,该反应能自发进行的条件是_______。(填“高温”、“低温”或“任意温度”)。
N2(g) + 2CO2(g) △ H=______,该反应能自发进行的条件是_______。(填“高温”、“低温”或“任意温度”)。
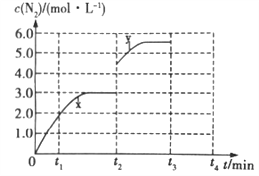
②若一定温度下,在容积可变的密闭容器中,上述反应Ⅳ达到平衡状态,此时容积为3L, c(N2)随时间 t 的变化曲线 x 如图所示。若在t2min时升高温度,t3min时重新达到平衡,请在图中画出在 t2~t4 内 c(N2)的变化曲线。______________
(2)利用H2 和CO2在一定条件下可以合成乙烯:6H2+2CO2![]() CH2=CH2+4H2O
CH2=CH2+4H2O
①不同温度对CO2的转化率及催化剂的催化效率的影响如图甲所示。
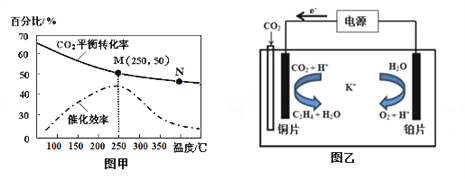
下列有关说法不正确的是_____(填序号)。
A.不同条件下反应,N点的速率最大
B.温度在约250℃时,催化剂的催化效率最高
C.相同条件下,乙烯的产量M点比N高
②若在密闭容器中充入体积比为 3∶1的 H2和CO2,则图甲中M点时,产物CH2=CH2的体积分数为________。(保留两位有效数字)
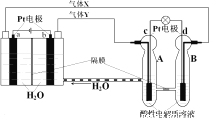
(3)利用一种钾盐水溶液作电解质,CO2电催化还原为乙烯,如图乙所示。在阴极上产生乙烯的电极反应方程式为___________________________________。
【答案】 -746.5 kJ·mol-1 低温 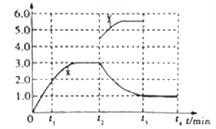 A 7.7% 或0.077 2CO2+12H++12e﹣=CH2=CH2+4H2O
A 7.7% 或0.077 2CO2+12H++12e﹣=CH2=CH2+4H2O
【解析】(1)①已知:
Ⅰ:C(s)+O2(g)=CO2(g) △H1=-393.5 kJ·mol-1
Ⅱ:2C(s)+O2(g)=2CO(g) △H2=-221 kJ·mol-1
Ⅲ:N2(g)+O2(g)=2NO(g) △H3=+180.5 kJ·mol-1
根据盖斯定律可知Ⅰ×2-Ⅱ-Ⅲ即得到反应Ⅳ:2NO(g)+2CO(g)![]() N2(g)+2CO2(g)的反应热△H=-746.5kJ·mol-1,由于正反应体积减小,即△S<0,根据△G=△H-T·△S<0可知该反应能自发进行的条件是低温。②升高温度平衡向逆反应方向进行,氮气浓度减小,达到新平衡时不再发生变化,所以图像可表示为
N2(g)+2CO2(g)的反应热△H=-746.5kJ·mol-1,由于正反应体积减小,即△S<0,根据△G=△H-T·△S<0可知该反应能自发进行的条件是低温。②升高温度平衡向逆反应方向进行,氮气浓度减小,达到新平衡时不再发生变化,所以图像可表示为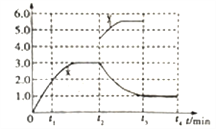 ;(2)①A.温度越高,反应速率越大,但M、N点温度、催化剂均不同,则N点速率不是最大的,A错误;B.温度在约250℃时,催化剂的催化效率对应转化率最大,则催化剂的催化效率最高,B正确;C.转化率越大,乙烯的产量越大,则相同条件下,乙烯的产量M点比N高,C正确;答案选A;②图中M点时,转化率为50%,在密闭容器中充入体积比为3:1的H2和CO2,则
;(2)①A.温度越高,反应速率越大,但M、N点温度、催化剂均不同,则N点速率不是最大的,A错误;B.温度在约250℃时,催化剂的催化效率对应转化率最大,则催化剂的催化效率最高,B正确;C.转化率越大,乙烯的产量越大,则相同条件下,乙烯的产量M点比N高,C正确;答案选A;②图中M点时,转化率为50%,在密闭容器中充入体积比为3:1的H2和CO2,则
6H2+2CO2![]() CH2=CH2+4H2O
CH2=CH2+4H2O
起始量(mol)3n n 0 0
转化量(mol)1.5n 0.5n 0.25n n
平衡量(mol)1.5n 0.5n 0.25n n
产物乙烯的体积分数为0.25n/(1.5n+0.5n+0.25n+n)×100%=7.7%或0.077。
(3)电解池的阴极发生得到电子的还原反应,即CO2得到电子转化为乙烯,电极反应式为2CO2+12H++12e﹣=CH2=CH2+4H2O。

 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案