题目内容
【题目】常温下, ![]() 化学键分解成气态原子所需要的能量用E表示。根据表中信息判断下列说法不正确的是
化学键分解成气态原子所需要的能量用E表示。根据表中信息判断下列说法不正确的是
共价键 |
|
|
|
|
|
| 436 | 157 | 568 | 432 | 298 |
A. ![]()
B. 表中最稳定的共价键是H-F键
C. ![]()
![]()
D. ![]()
![]()
【答案】D
【解析】A.依据溴原子半径大于氯原子小于碘原子,半径越大键能越小,所以结合图表中数据可知432 kJmol-1>E(H-Br)>298 kJmol-1,故A正确;B.键能越大形成的化学键越稳定,表中键能最大的是H-F,最稳定的共价键是H-F键,故B正确;C.氢气变化为氢原子吸热等于氢气中断裂化学键需要的能量,H2(g)→2H (g)△H=+436 kJmol-1 ,故C正确;D.依据键能计算反应焓变=反应物键能总和-生成物键能总和计算判断,△H=436kJ/mol+157kJ/mol -2×568kJ/mol=-543kJ/mol,H2(g)+F2(g)=2HF(g)△H=-543 kJmol-1,故D错误;故选D。

练习册系列答案
相关题目
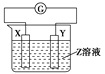
【题目】X、Y两根金属棒插入Z溶液中构成如图所示的装置,实验中电流计指针发生偏转,同时X棒变粗,Y棒变细,则X、Y和Z溶液可能是下列中的( )
编号 | X | Y | Z溶液 |
|
A | Zn | Cu | 稀硫酸 | |
B | Cu | Zn | 稀硫酸 | |
C | Cu | Ag | 硫酸铜溶液 | |
D | Ag | Zn | 硝酸银溶液 |
A. A B. B C. C D. D